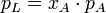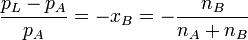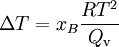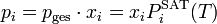- Gesetz von Raoult
-
Als Raoultsches Gesetz werden verschiedene auf François Marie Raoult zurückgehende Gesetzmäßigkeiten der Chemie und der Thermodynamik bezeichnet.
Inhaltsverzeichnis
Raoultsches Gesetz der Dampfdruckerniedrigung
Im Stoffgemisch einer Lösung tritt der Lösungseffekt auf. Die relative Erniedrigung des Sättigungsdampfdrucks über der Lösung mit ebener Oberfläche (Krümmungseffekt) ist dabei gleich dem Produkt aus dem Dampfdruck des Lösungsmittels mal seinem Stoffmengenanteil. Die Dampfdruckerniedrigung ist somit kolligativ, also nur von der Teilchenzahl des gelösten Stoffes und nicht von dessen chemischen Eigenschaften abhängig.
Hierbei stehen die einzelnen Formelzeichen für die folgenden Größen:
- n – Stoffmenge des gelösten Stoffes B und des Lösungsmittels A
- pL – Partialdruck bzw. Dampfdruck über der Lösung
- pA – Dampfdruck des reinen Lösungsmittels
- xA – Stoffmengenanteil des Lösungsmittels
- xB – Stoffmengenanteil der gelösten Substanz bzw. relative Dampfdruckerniedrigung
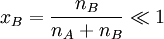 , für verdünnte Lösungen
, für verdünnte Lösungen
Raoultsches Gesetz der Siedepunkterhöhung
Der obige Lösungseffekt ist für die Siedepunkterhöhung verantwortlich. Dabei ergibt sich mit der Clausius-Clapeyron-Gleichung folgender Zusammenhang:
Dabei ist R die allgemeine Gaskonstante, T die Temperatur und Qv die molare Verdampfungswärme.
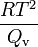 ist eine Proportionalitätskonstante (ebullioskopische Konstante), die nur von den Eigenschaften des Lösungsmittels abhängt.
ist eine Proportionalitätskonstante (ebullioskopische Konstante), die nur von den Eigenschaften des Lösungsmittels abhängt.
Ersetzt man Qv mit der molaren Schmelzwärme Qs so erhält man die Gefrierpunkterniedrigung.
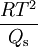 nennt man dann kryoskopische Konstante.
nennt man dann kryoskopische Konstante.
Mit dem raoultschem Gesetz kann man das Molargewicht eines gelösten Stoffes bestimmen. Das funktioniert, da die Dampfdruckerniedrigung unabhängig von der Art des gelösten Stoffes ist und nur von der Konzentration der gelösten Teilchen abhängt. Anhand der Siedepunkterhöhung lässt sich somit die molare Konzentration und damit das Molargewicht [g/mol] des gelösten Stoffes berechnen.Gesetz zur Berechnung des Dampf-Flüssig-Gleichgewichts
Im Bereich der Mischphasenthermodynamik wird das Raoultsche Gesetz zur Berechnung des Dampf-Flüssig-Gleichgewichts verwendet.
Ausgehend von Isofugazität von Dampf- und Flüssigphase lässt sich mittels des Partialdrucks
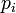 einer reinen Komponente (selbstverständlich in der Dampfphase) und deren Sättigungsdampfdruck
einer reinen Komponente (selbstverständlich in der Dampfphase) und deren Sättigungsdampfdruck 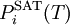 die molare Konzentration
die molare Konzentration 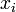 in der Flüssigphase bestimmen.
in der Flüssigphase bestimmen.Es gilt unter Annahme, dass sich sowohl die Dampf- als auch die Flüssigphase ideal verhalten und ein moderater Druck
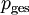 herrscht:
herrscht:
Wikimedia Foundation.