- Glykogenphosphorylase
-
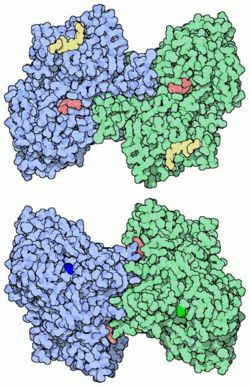
Glycogenphosphorylase Kalottenmodelle des Dimer nach PDB 6GPB Größe 842/846/841 Aminosäuren Struktur Dimer mit zwei Homodimeren Kofaktor Pyridoxalphosphat Isoformen Brain, Liver, Muscle Bezeichner Gen-Name(n) PYGB, PYGL, PYGM Enzymklassifikation EC, Kategorie 2.4.1.1 Glycosyltransferase Reaktionsart Abspaltung und Übertragung eines Glucoserests auf Phosphat Substrat (1,4-α-D-Glucosyl)n + Phosphat Produkte (1,4-α-D-Glucosyl)n-1 + α-D-Glucose-1-Phosphat Vorkommen Übergeordnetes Taxon Lebewesen Die Glycogenphosphorylase (PYG) (1,4-α-D-Glucan:phosphat α-D-Glucosyltransferase) ist ein cytosolisches Enzym des Glycogenstoffwechsels, welches die phosphorolytische Spaltung des Glycogens in Glucose-1-phosphat katalysiert. Es kommt in den Unterformen PYGB (Gehirn, Herz), PYGM (Muskel) und PYGL (Leber) vor.
Inhaltsverzeichnis
Hintergrund
Der Zucker Glucose ist ein zentrales Molekül im Energiestoffwechsel und biosynthetischer Vorläufer einer großen Zahl biologisch wichtiger Verbindungen, darunter nicht essentielle Aminosäuren, Fettsäuren u. a. Glycogen ist ein Polymer aus Glucose-Einheiten und dient dem tierischen Organismus als Speicherform der Glucose ähnlich der Stärke in Pflanzen. Zur Mobilisierung der Glucose aus dem Speichermolekül Glycogen wird die katalytische Aktivität der Glycogenphosphorylase benötigt.
Struktur und Eigenschaften
Die Glycogenphosphorylase ist ein Homodimer mit einer Monomermasse von 97 kDa (Mensch). Es gibt drei Isoformen, die Gehirn- (BB), Muskel- (MM) und Leber- (LL) Glycogenphosphorylase. Alle Isoenzyme benötigen für ihre Aktivität Pyridoxalphosphat. Die KM-Werte für Glycogen liegen im oberen μM- bis unteren mM-Bereich. Die Glycogenphosphorylase wird durch Glucose und ATP inhibiert sowie durch AMP aktiviert, wobei die Ausprägung der Effektorwirkung von der Isoform abhängig ist. Die spezifische Aktivität liegt im Bereich von einigen zehn U/mg Protein.
Genetische Erkrankungen
Gendefekte der Muskelisoform der Glycogenphosphorylase führen zur McArdle-Krankheit. Mutationen in der Leber-Isoform können zu Morbus Hers führen. Für die Gehirn-Isoform ist keine entsprechende Erkrankung bekannt.
siehe auch
Literatur
- Berg/Tymoczko/Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3827413036
Weblinks
Brenda-Eintrag (The Comprehensive Enzyme Information System)
Wikimedia Foundation.