- Interferenzreflexionsmikroskopie
-
Interferenzreflexionsmikroskopie (auch: Reflexionskontrastmikroskopie) ist eine lichtmikroskopische Methode, bei der die Dicke sehr dünner Strukturen bestimmt wird. Sie beruht auf der Bildung von Interferenzen, die entstehen, wenn Licht an der oberen und unteren Grenzfläche der Struktur gebrochen wird und gebrochenes Licht von beiden Grenzflächen miteinander interferiert. Dadurch entstehen Interferenzmuster, die beobachtet werden können, und die Aufschluss über die Dicke der Struktur liefern. [1][2]
Die entstehenden Interferenzfarben lassen Dickemessungen im Bereich unter 200 Nanometer zu, also unterhalb der normalen Auflösung des Lichtmikroskops. Da die Interferenzfarben durch ein Lichtmikroskop beobachtet werden, können diese Dickemessungen entsprechend zu mikroskopisch erkennbaren Strukturen zugeordnet werden, etwa einzelnen Ausläufern von Zellen. Ähnlich wie bei der Internen Totalreflexionsfluoreszenzmikroskopie (TIRF) ist die Beobachtung auf Objekte an der Präparatoberfläche, also in der Nähe des Deckglases, beschränkt.
Das Verfahren hat von verschiedenen Autoren unterschiedliche Namen erhalten. Die älteste Bezeichnung (1964) ist Interference Reflection Microscopy (IRM), auf deutsch Interferenzreflexionsmikroskopie. Weitere Bezeichnungen sind Reflection Contrast Microscopy (RCM; 1975), auf deutsch Reflexionskontrastmikroskopie, und Reflection Interference Contrast Microscopy (RICM, 1981).[2][3] Eine englische Übersichtsarbeit aus dem Jahr 2000 listet außerdem: interference contrast, interference reflection contrast, reflection interference contrast, surface reflection interference und surface contrast microscopy.[4]
Inhaltsverzeichnis
Geschichte und Anwendungsbereiche
Die Technik wurde erstmals 1958 beziehungsweise 1960 für die Untersuchung von dünnen Schichten eingesetzt und 1964 in die Zellbiologie eingeführt. Erst etwa zehn Jahre später wurden weitere Arbeiten publiziert. In den 1970er wurde die Technik weiterentwickelt und von Ernst Leitz sowie Carl Zeiss kommerziell angeboten.[1][4][2] Das Verfahren hat sich nicht breit durchsetzen können, für spezielle Anwendungen kam es in den 1970er und 1980er Jahren zu einer Häufung von Veröffentlichungen.[4]
Eingesetzt wurde Interferenzreflexionsmikroskopie besonders häufig für die Untersuchung von Zelladhäsion an Glas und die Bestimmung der Dicke von Zellausläufern (Pseudopodien)[1]. Fokale Adhäsionspunkte wurden 1976 erstmals mit dieser Technik beschrieben[2]. Andere Anwendungen waren die Untersuchung von Retikulozyten in Blutaustrichen, da diese sich bei diesem Verfahren von roten Blutkörperchen (Erythrozyten) unterscheiden lassen[5], sowie Untersuchungen von Chromosomenpräparaten und des Cytoskeletts in fixierten Zellen.[2]
Funktionsprinzip am Beispiel der Zelladhäsion
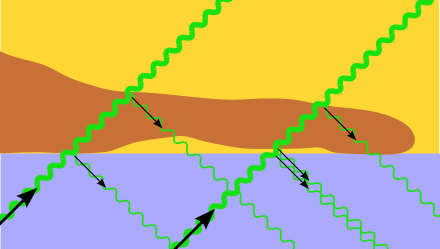 Schematische Darstellung der Interferenzreflexionsmikroskopie. Zwei Lichtstrahlen (dickere grüne gewellte Linien) kommen von unten durch ein Deckglas (grau) und treffen entweder auf eine Zelle (braun) oder zuerst auf wässriges Zellkulturmedium (ockergelb) und dann auf die Zelle. Wo der Lichtstrahl vom Deckglas direkt in die Zelle übertritt (linken Seite) gibt es Reflexion (dünner grüner Strahl). Ist dagegen ein kleiner Zwischenraum zwischen Zelle und Deckglas (rechte Seite) entsteht eine Reflexion an der Deckglas-Medium-Grenze und eine weitere an der Medium-Zellen-Grenze. Die beiden entstehenden Strahlen können miteinander interferieren. Die Brechung des Lichts an Grenzflächen wurde hier ignoriert.
Schematische Darstellung der Interferenzreflexionsmikroskopie. Zwei Lichtstrahlen (dickere grüne gewellte Linien) kommen von unten durch ein Deckglas (grau) und treffen entweder auf eine Zelle (braun) oder zuerst auf wässriges Zellkulturmedium (ockergelb) und dann auf die Zelle. Wo der Lichtstrahl vom Deckglas direkt in die Zelle übertritt (linken Seite) gibt es Reflexion (dünner grüner Strahl). Ist dagegen ein kleiner Zwischenraum zwischen Zelle und Deckglas (rechte Seite) entsteht eine Reflexion an der Deckglas-Medium-Grenze und eine weitere an der Medium-Zellen-Grenze. Die beiden entstehenden Strahlen können miteinander interferieren. Die Brechung des Lichts an Grenzflächen wurde hier ignoriert.
Interferenzreflexionsmikroskopie beruht auf Auflichtbeleuchtung, Reflexion und Interferenz. Um den Kontrast vermindernde Reflexionen an Glasoberflächen zu minimieren, kommt Ölimmersion mit reflexionsarmen Objektiven zum Einsatz. Eine Zentralblende im Beleuchtungsstrahlengang blockiert außerdem Reflexionen aus zentralen Bereich des Objektivs, wo diese besonders störend wirken. [1] Aus praktischen Gründen wird in zellbiologischen Anwendungen ein umgekehrtes (inverses) Mikroskop eingesetzt, so dass sich die Zellen auf einem Deckglas befinden und von unten beobachtet werden.
Bei Auflicht wird das Bild eines transparenten Objekts durch Reflexion des Lichts an Grenzflächen verursacht, an denen sich der Brechungsindex ändert. Die Intensität des zurückgeworfenen Lichts ist dabei um so stärker desto stärker der Brechungsindex-Unterschied ist. Immersionsöl und Glas haben einen sehr ähnlichen Brechungsindex. Bei einem Präparat mit lebenden Zellen, die auf einem Deckglas wachsen und bei Ölimmersion mit Auflicht (im inversen Mikroskop von unten) beleuchtet werden, tritt daher der erste Brechungsindexunterschied am Übergang vom Deckglas zum wässrigen Medium auf, in dem sich die Zellen befinden. Hierbei entsteht eine vergleichsweise starke Reflexion. Befindet sich jedoch eine Zelle an der Stelle, so ist der Brechungsindex-Unterschied, hier zwischen Deckglas und Zelle beziehungsweise Zellmembran, deutlich geringer, die Reflexion entsprechend schwächer.[2]
Befindet sich zwischen der Zelle und dem Deckglas noch ein mit Medium gefüllter Zwischenraum, so kann dessen Dicke mit Hilfe der Interferenzreflexionsmikroskopie untersucht werden: Reflexion findet zuerst am Übergang Deckglas-Medium und dann am Übergang Medium-Zelle statt. Wenn der Abstand zwischen diesen beiden Übergängen in der Größenordnung der Wellenlänge des verwendeten Lichts liegt, können die beiden reflektierten Strahlen miteinander interferieren. Bei der Verwendung von monochromatischem Licht, das nur eine oder wenige Wellenlängen enthält, entstehen daher helle und dunkle Bereiche. Bei weißem Licht entstehen dagegen bunte Bereiche, je nachdem welche Wellenlängen negativ oder positiv interferieren. Aus diesen Beobachtungen lassen sich daher Informationen über den Abstand von Zelle zum Deckglas ablesen, und zwar in Größenordnungen, die unter der üblichen Auflösungsgrenze eines Lichtmikroskops (≈ 200 Nanometer) liegen.
Der beschriebene Effekt kann jedoch erheblich gestört werden durch reflektierte Strahlen, die an anderen Grenzflächen entstehen, beispielsweise bei flachen Zellfortsätzen vom Übergang der hinteren Zellmembran in das umgebende Medium. Dieses Problem wird vermindert, wenn die Beleuchtung mit hoher Numerischer Apertur erfolgt und die Zelle mindestens einen Mikrometer dick ist, da die obere Zellmembran dann aufgrund der optischen Gegebenheiten nicht mehr zum Interferenzbild beitragen kann. Unter Berücksichtigung der Zelldicke lassen sich dann quantitative Untersuchungen durchführen. Häufiger wurden jedoch qualitative Untersuchungen durchgeführt, beispielsweise zur Verteilung Fokaler Adhäsionspunkte.[2]
Durch den Einsatz von Polarisationsfiltern im Strahlengang und einem λ/4-Plättchen im Objektiv (Antiflex-Objektiv), wird Licht, das an Glasoberflächen innerhalb des Objektivs selbst reflektiert wird, herausgefiltert. Am gleichen Mikroskop lässt sich auch Zubehör für andere Spezialverfahren anbringen, wie beispielsweise Fluoreszenzmikroskopie oder Differentialinterferenzkontrast, so dass sich diese Techniken kombinieren lassen.[2]
Weblinks
- „Dreidimensionale Zytometrie und Rekonstruktion des Reliefs roter Blutzellen im Reflexionskontrast“ mit Abbildungen, prof-piper.com.
- Das Prinzip der verwandten Technik „Confocal Reflection Microscopy“, Reflexionsmikroskopie mit dem Konfokalmikroskop (auf englisch)
Einzelnachweise
- ↑ a b c d W. J. Patzelt: Reflexionskontrast, ein neues mikroskopisches Verfahren. In: Naturwissenschaften. 63, Nr. 11, November 1976, S. 535. doi:10.1007/BF00596860. PMID 1004619.
- ↑ a b c d e f g h H. Verschueren: Interference reflection microscopy in cell biology: methodology and applications. In: J. Cell. Sci.. 75, April 1985, S. 279–301. PMID 3900106.
- ↑ R. Parthasarathy, J. T. Groves: Optical techniques for imaging membrane topography. In: Cell Biochem. Biophys.. 41, Nr. 3, 2004, S. 391–414. doi:10.1385/CBB:41:3:391. PMID 15509889.
- ↑ a b c T. J. Filler, E. T. Peuker: Reflection contrast microscopy (RCM): a forgotten technique?. In: J. Pathol.. 190, Nr. 5, April 2000, S. 635–638. doi:10.1002/(SICI)1096-9896(200004)190:5<635::AID-PATH571>3.0.CO;2-E. PMID 10727991.
- ↑ F. Pera: Nachweis von Reticulocyten und plastische Darstellung der Blutzellen mittels Reflexionskontrast. In: Journal of Molecular Medicine. 58, Nr. 22, November 1980, S. 1261–1266. doi:10.1007/BF01478933.
Wikimedia Foundation.
