- Ionisationsenergie
-
Die Ionisierungsenergie (auch Ionisationsenergie, Ionisierungspotential, Ionisierungsenthalpie) ist die Energie, die benötigt wird, um ein Atom oder Molekül zu ionisieren, d. h. um ein Elektron vom Atom oder Molekül zu trennen. Allgemein ist die n-te Ionisierungsenergie die Energie, die benötigt wird, um das n-te Elektron zu entfernen, nachdem die ersten n-1 Elektronen bereits entfernt worden sind.
Nach der Ionisierung hat ein vorher elektrisch neutrales Atom oder Molekül eine positive elektrische Ladung. Die vorher ausgeglichene Ladungsdifferenz zwischen Atomkern (oder Atomkernen) und Elektronenhülle ist durch das Entfernen eines Elektrons verschoben. Man spricht von einem positiv ionisierten Atom bzw. Molekül oder einem Kation. Dieses kennzeichnet man durch ein nachfolgend hochgestelltes '+'-Zeichen; beispielsweise wird ein Natriumkation als Na+ gekennzeichnet (das Elementsymbol für Natrium ist Na).
Solange ein Kation noch Elektronen besitzt, kann es durch weitere Energiezufuhr weiter ionisiert werden. Allerdings nimmt die erforderliche Energie mit jeder zusätzlichen Ionisierung zu. Symbolisch wird ein mehrfach ionisiertes Kation durch eine vor das '+'-Zeichen gestellte Zahl identifiziert; beispielsweise wird ein 3-fach ionisiertes Aluminiumkation als Al3+ bezeichnet.
Für ein einzelnes Elektron wird die Ionisierungsenergie in eV/Atom angegeben, für 1 Mol Elektronen aber in kJ/mol. Der Umrechnungsfaktor ergibt sich aus der Umrechnung zwischen eV und kJ sowie der Avogadro-Konstante NA zu: 1 eV = 96,485307 kJ/mol.
Die Ionisierungsenergie kann durch Strahlung (Ionisierende Strahlung), eine hohe Temperatur des Materials oder chemisch geliefert werden.
Ionisierungsenergie und Periodensystem
Die 1. Ionisierungsenergie hängt stark von der Anziehungskraft zwischen Atomkern und dem zu entfernenden Elektron ab, welche sich nach der Coulomb-Formel
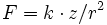 berechnet. Demnach steigt die 1. Ionisierungsenergie innerhalb einer Periode stetig an, weil die Kernladungszahl z zunimmt. Innerhalb einer Gruppe dagegen sinkt die Ionisierungsenergie von oben nach unten, weil der Abstand r zwischen Kern und Elektron immer größer wird. Beim Übergang von einer Periode zur nächsten, z.B. vom Neon zum Natrium, nimmt die 1. Ionisierungsenergie schlagartig ab, weil sich – nach dem Schalenmodell des Atoms – das zu entfernende Elektron auf einer neuen Schale befindet.
berechnet. Demnach steigt die 1. Ionisierungsenergie innerhalb einer Periode stetig an, weil die Kernladungszahl z zunimmt. Innerhalb einer Gruppe dagegen sinkt die Ionisierungsenergie von oben nach unten, weil der Abstand r zwischen Kern und Elektron immer größer wird. Beim Übergang von einer Periode zur nächsten, z.B. vom Neon zum Natrium, nimmt die 1. Ionisierungsenergie schlagartig ab, weil sich – nach dem Schalenmodell des Atoms – das zu entfernende Elektron auf einer neuen Schale befindet.Die Ionisierungsenergien der Alkalimetalle stellen in jeder Periode das Minimum dar. Die Edelgase haben in jeder Periode maximale Ionisierungsenergien. Die Maxima und Minima werden von Periode zu Periode geringer, da die Elektronen weiter vom Kern entfernt sind und weniger Energie aufgewendet werden muss, um sie aus dessen Anziehungskraft zu lösen.
Weblinks
Wikimedia Foundation.

