- Langmuir-Isotherme
-
Sorptionsisothermen (oft auch Adsorptionsisothermen genannt) beschreiben den Gleichgewichtszustand der Sorption eines Stoffes an einer Oberfläche (allgemeiner an einer Grenzfläche) bei konstanter Temperatur. Sie stellen die an der Oberfläche gebundene Stoffmenge (das Sorbat) in Abhängigkeit von der in der Gasphase bzw. in der Lösung befindlichen Stoffmenge dar. Sorptionsisothermen werden oftmals als empirische Modelle benutzt[1], die keine Aussagen über zugrunde liegende Mechanismen und Einflussgrößen machen. Sie werden aus Messdaten mittels Regressionsanalysen gewonnen.
Nachfolgend werden die am häufigsten verwendeten Isothermen aufgeführt. Es existieren noch zahlreiche weitere Modelle, die oft Modifikationen der genannten Modelle sind.
Inhaltsverzeichnis
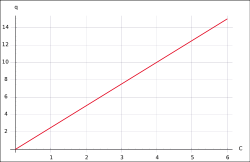
Lineare Isotherme
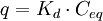
- q – Beladung des Sorbents (Masse Sorbat bezogen auf Masse Sorbent)
- Kd – linearer Koeffizient, Kd-Wert
- Ceq – Konzentration des Sorbats in Lösung
Lineare Isothermen erfreuen sich großer Beliebtheit, da sie Berechnungen stark vereinfachen. Daher werden sie häufig auch verwendet, wenn eigentlich kompliziertere Modelle verwendet werden müssten. Anwendbar sind sie zumeist nur für den Bereich niedriger Konzentrationen.
Lineare Isothermen werden besonders für die Sorption von Gasen in Flüssigkeiten auch Henry-Isothermen genannt. Siehe auch: Henry-Gesetz.
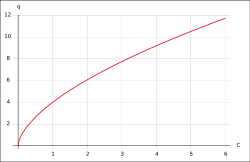
Freundlich-Isotherme
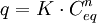
- q – Beladung des Sorbents (Masse Sorbat bezogen auf Masse Sorbent)
- K – Freundlich-Koeffizient
- Ceq – Konzentration des Sorbats in Lösung
- n – Freundlich-Exponent (Um Zahlen größer 1 angeben zu können, wird das n in der Gleichung häufig durch 1/n ersetzt.)
Freundlich-Isothermen[2] tragen der Tatsache Rechnung, dass bei stärkerer Beladung der Sorptionsoberflächen des Sorbenten weniger Sorbat aufgenommen werden kann. Aufgrund des Potenz-Wachstums kann jedoch eine vollständige Beladung der Oberflächen nicht abgebildet werden.
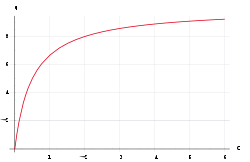
Langmuir-Isotherme
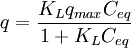
- q – Beladung des Sorbents (Masse Sorbat bezogen auf Masse Sorbent)
- KL – Langmuir-Sorptionskoeffizient
- qmax – maximal sorbierbare Konzentration des Sorbats (Masse Sorbat bezogen auf Masse Sorbent)
- Ceq – Konzentration des Sorbats in Lösung
Die Langmuir-Isotherme[3] ist das einfachste Sorptionsmodell, das physikalische Grundlagen besitzt.[1] Es werden die Annahmen getroffen, dass
- Adsorption in einer einzelnen molekularen Schicht stattfindet,
- alle Sorptionsplätze gleichwertig sind und die Oberfläche gleichförmig ist,
- es keine Wechselwirkungen zwischen benachbarten Sorptionsplätzen und den adsorbierten Teilchen gibt.
Die Langmuir-Isotherme kann eine maximale Beladung der Sorptionsoberflächen abbilden.
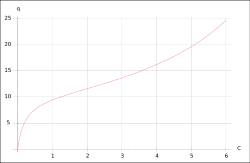
BET-Modell
![q=\frac{Kq_{max}C_{eq}}{(C_{sat}-C_{eq})[1+(K-1)C_{eq}/C_{sat}]}](/pictures/dewiki/97/af8edd89a82422063eead1bc7292b80c.png)
- q – Beladung des Sorbents (Masse Sorbat bezogen auf Masse Sorbent)
- K – Sorptionskoeffizient
- qmax – maximale Konzentration des Sorbats in einer Schicht an der Oberfläche des Sorbenten (Masse Sorbat bezogen auf Masse Sorbent)
- Ceq – Konzentration des Sorbats in Lösung
- Csat – Löslichkeit des Sorbats
Das BET-Modell[4] erweitert die Langmuir-Isotherme um das Verhalten bei hoher Konzentration des Sorbats nahe der Löslichkeit bzw. Sättigungskonzentration. Grundlage des Modells ist Sorption in mehreren molekularen Schichten an der Oberfläche des Sorbenten. Die Beladung kann daher ins Unendliche steigen. Das Modell findet bei der Oberflächenmessung Anwendung.
Literatur
- ↑ a b Atkins, P. W., "Physical Chemistry", Oxford University Press, 6. Auflage, 1998, ISBN 0-19-850101-3
- ↑ Freundlich, H., "Über die Adsorption in Lösungen", Z. Phys. Chem., 57, S. 385-470, 1907
- ↑ Langmuir, I., "Surface Chemistry", Nobel Lecture, December 14, 1932, In: Nobel Lectures, Chemistry 1922-1941, Elsevier Publishing Company, Amsterdam, 1966 PDF auf nobelprize.org
- ↑ Brunauer, S., Emmett, P.H., Teller, E., "Adsorption of Gases on Multimolecular Layers", J.Am.Chem.Soc., 60(2), S. 309-319, 1938
Wikimedia Foundation.