- Malonester
-
Strukturformel 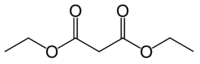
Allgemeines Name Malonsäurediethylester Andere Namen - Diethylmalonat
- Malonester
Summenformel C7H12O4 CAS-Nummer 105-53-3 PubChem 68185 Kurzbeschreibung Angenehm riechende farblose Flüssigkeit Eigenschaften Molare Masse 160,17 g/mol Aggregatzustand flüssig
Dichte 1,0554 g/cm3 [1]
Schmelzpunkt −50 °C (223 K) [1]
Siedepunkt 199 °C (92 °C bei 18 mbar) [1]
Dampfdruck 1,3 hPa (20 °C) [1]
Löslichkeit leicht löslich in fast allen organischen Lösemitteln, gering löslich in Wasser [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 24/25 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Malonsäurediethylester ist eine farblose angenehm riechende Flüssigkeit, die zu den Estern zählt.
Inhaltsverzeichnis
Gewinnung und Darstellung
Malonsäurediethylester kann nicht aus der freien Säure durch Verestern mit Ethanol gewonnen werden, weil Malonsäure bei erhöhten Temperaturen zu Essigsäure und CO2 zerfällt (Decarboxylierung). Zur Darstellung muss das Kaliumsalz der Cyanessigsäure mit Ethanol und konzentrierten Mineralsäuren umgesetzt werden.[3]
Eigenschaften
Physikalische Eigenschaften
Die Viskosität beträgt bei 20 °C 2,1 mPa·s.[2]
Chemische Eigenschaften
Die Methylenprotonen des Malonsäurediethylester sind leicht acid; daher kann er mit starken Basen wie z. B. Natriumethanolat deprotoniert werden. Diese deprotonierte Form ist ein Carbanion und kann mit Alkylhalogeniden zu alkylsubstituierten Malonsäurediethylestern umgesetzt werden (Malonestersynthese). Andere Reaktionsmöglichkeiten dieses Carbanions:
- Reaktion mit Carbonylderivaten (Aldehyde oder Ketone) führt zu Aldolprodukten
- Reaktion mit Carbonsäurederivaten führt zur Acylierung
Verwendung
Werden alkylsubstituierte Malonsäurediethylester verseift und erhitzt, decarboxylieren sie wie die Malonsäure; es entstehen substituierte Essigsäurederivate. Alkylsubstituierte Malonsäurediethylester können weiterhin mit Harnstoff zu Barbitursäurederivaten umgesetzt werden. Die Reaktion ist mit der Knoevenagel-Reaktion verwandt.
Quellen
Wikimedia Foundation.
