- Malonestersynthese
-
Die Malonestersynthese ist eine Reaktion in der organischen Chemie zur Herstellung von alkylierten Malonsäureestern. Sie dient dazu, nach Verseifung und anschließender Decarboxylierung, substituierte Essigsäuren zu erhalten.
Inhaltsverzeichnis
Mechanismus
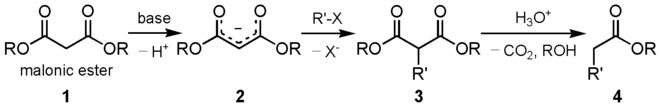
Im ersten Schritt wird der Malonester durch eine Base wie z. B. einem Alkoholat in α-Position d. h. an der Methylen-Gruppe deprotoniert. Anschließend wird ein Halogenalkan vom deprotonierten α-Kohlenstoff, nucleophil angegriffen. Man erhält einen α-alkylierten Malonester. Die Estergruppen werden säurekatalysiert hydrolysiert. Durch Hitzeeinwirkung decarboxyliert (CO2 wird abgespalten) die zuvor entstandene Dicarbonsäure. (Die Dicarbonsäure ist in der Abbildung nicht dargestellt)

- Synthese einer α-disubstituierten Carbonsäure aus dem für gewöhnlich verwendeten Malonsäurediethylester. (X = Br, Cl oder I, R = Alkylrest)
Funktionsweise
Durch die Flankierung des α-Kohlenstoffs durch zwei Estergruppen sind die dort gebundenen Wasserstoffatome besonders acide (pKs = 13).[1] Folglich ist eine Deprotonierung an dieser Position begünstigt. Die Estergruppen lassen sich säurekatalysiert hydrolysieren (Esterhydrolyse). Aufgrund der resultierenden Carbonsäure in β-Position ist eine Decarboxylierung durch Erhitzen stark erleichtert und wird durch die sauren Reaktionsbedingungen noch weiter begünstigt. Die nucleophile Substitution des Halogenalkans folgt einem SN2-Mechanismus. Demnach sind verzweigte Alkylreste des Halogenalkans wegen der sterischen Hinderung für die Reaktion ungünstig. Hinsichtlich der nucleophilen Eigenschaften von Basen, sollte eine Base verwendet werden, die bei einer Substitution von einem der Carbonylkohlenstoffe zum gleichen Ester führt. Beispielsweise für Malonsäurediethylester, Ethanolat.
Einzelnachweise
- ↑ Paula, Yurkanis, Bruice: Organic Chemistry. 4. Auflage, Prentice-Hall, 2003, ISBN 0-131-41010-5, S. 821.
Literatur
- Paula, Yurkanis, Bruice: Organic Chemistry. 4. Auflage, Prentice-Hall, 2003, ISBN 0-131-41010-5, S. 821 f.
- K.P.C. Vollhardt, Neil E. Schore, Organische Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, 4.Auflage, H. Butenschön, ISBN 3-527-31380-X, S. 1228 f.
Wikimedia Foundation.