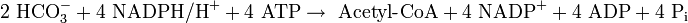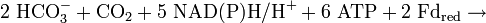- 3-Hydroxypropionat/4-Hydroxybutyratzyklus
-
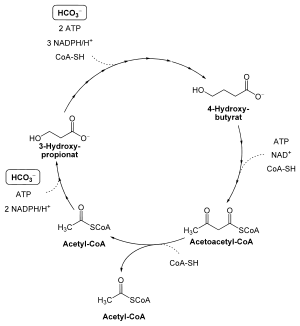
Der 3-Hydroxypropionat/4-Hydroxybutyratzyklus ist ein biochemischer Zyklus, der es einigen Archaea erlaubt, Kohlenstoffdioxid in Form von Bicarbonat (HCO3−) zu assimilieren. Der Zyklus verdankt seinen Namen, da als Intermediate 3-Hydroxypropionat bzw. 4-Hydroxybutyrat gebildet werden.
Inhaltsverzeichnis
Vorkommen
Der Stoffwechselweg wurde in thermoacidophilen Archaea der Gattungen Metallosphaera, Acidianus und Sulfolobus nachgewiesen. Diese Mikroorganismen sind entweder mikroaerophil oder im Falle von Archaeoglobus strikt anaerob.[1]
Biochemie
Ausgehend von Acetyl-CoA wird in zwei Reaktionsschritten Malonat-Semialdehyd gebildet, welches durch eine Malonat-Semialdehyd-Reduktase in 3-Hydroxypropionat reduziert wird. Für diese Reaktionsschritte werden zwei Moleküle NADPH, ein Molekül ATP und ein Molekül Bicarbonat benötigt. 3-Hydroxypropionat wird über Succinyl-CoA in weiteren Schritten zu 4-Hydroxybutyrat umgesetzt, was drei Moleküle NADPH, zwei Moleküle ATP, ein weiteres Molekül Bicarbonat und Coenzym A erfordert. Dabei katalysiert das Enzym Succinat-Semialdehyd-Reduktase unter NADPH-Verbrauch die Bildung von 4-Hydroxybutyrat aus Succinat-Semialdehyd.
Schließlich wird 4-Hydroxybutyrat zu Acetoacetyl-CoA unter Verbrauch je eines Moleküls ATP und Coenzym A sowie NAD+ umgesetzt. Dieses wird durch eine Acetoacetyl-CoA β-Ketothiolase in zwei Moleküle Acetyl-CoA gespaltet, so dass sich hier der Zyklus schließt und ein Acetyl-CoA freigesetzt wird.
Die Gesamtbilanz für die Bildung von einem Molekül Acetyl-CoA lautet folglich (ohne Bezug auf Coenzym A):
Biologische Bedeutung
Dieser Stoffwechselweg wurde erst kürzlich entdeckt und stellt eine Variante des 3-Hydroxypropionatzyklus dar. Bis zur Bildung von Succinyl-CoA entsprechen sich die beiden Zyklen weitgehenst. Jedoch sind die darin beteiligten Enzyme phylogenetisch nicht verwandt und scheinen sich unabhängig voneinander entwickelt zu haben.[1]
Die Empfindlichkeit gegenüber Sauerstoff kann man damit erklären, dass ein involviertes Enzym, die 4-Hydroxybutyryl-CoA-Dehydratase, sensitiv gegenüber Sauerstoff ist.[2]
Das durch den Kreislauf gebildete Acetyl-CoA kann zu Glycerinaldehyd-3-Phosphat (G3P) aufgebaut werden und in den Baustoffwechsel einfließen. Hierbei werden weitere Cofaktoren, z. B. Ferredoxin (Fd), benötigt. Die Gesamtbilanz für die Bildung eines Moleküls G3P lautet somit:
Der Aufbau einer phosphorylierten Triose, G3P, ähnelt energetisch gesehen dem Stoffwechselweg des Calvin-Zyklus, da auch hier neuen ATP-Äquivalente verbraucht werden (AMP zählt doppelt). Beim Calvin-Zyklus geht jedoch durch die auftretende Photorespiration immer etwas Energie verloren. Darüber hinaus haben die bei der Bicarbonatfixierung beteiligten Carboxylasen eine höhere Wechselzahl (28 s−1 bei 65 °C) als RuBisCO beim Calvin-Zyklus (5 s−1).
Quellen
- ↑ a b Thauer, RK. (2007): Microbiology. A fifth pathway of carbon fixation. In: Science 318(5857); 1782–1783; PMID 18079388; doi:10.1126/science.1152209
- ↑ Martins, BM. et al. (2004): Crystal structure of 4-hydroxybutyryl-CoA dehydratase: Radical catalysis involving a [4Fe–4S] cluster and flavin. In: PNAS 101(44); 15645–15649; PMID 15496473; PDF (freier Volltextzugriff, engl.)
Literatur
- Berg, IA. et al. (2007): A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea. In: Science 318(5857); 1782–1786; PMID 18079405; doi:10.1126/science.1149976
Siehe auch
Wikimedia Foundation.