- Musulin-Frost-Diagramm
-
Der Frost-Kreis ist ein einfaches graphisches Hilfsmittel zur Verdeutlichung des aromatischen Charakters eines ungesättigten Monocyclus. Mit Begin der Quantenchemie in der ersten Hälfte des 20. Jahrhunderts wurden einige Aromatizitäts-Kriterien entwickelt. Ein wichtiges Ergebnis seiner theoretischen Arbeiten fand Erich Hückel (1896–1980) in den 1930er Jahren.
Nach der Hückel-Regel gilt:
- Aromatisch sind monocyclische planare Moleküle mit (4n + 2) π-Elektronen.
- Dabei zeichnen sich die π-Elektronen dadurch aus, dass sie sich oberhalb und unterhalb, nicht aber in der Molekülebene des planaren Aromaten aufhalten. [1]
Die experimentell beobachtete besondere Stabilität von Benzol (Summenformel: C6H6), dem Prototyp einer aromatischen Verbindung, erklärte Hückel mit der doppelten Besetzung aller verfügbaren bindenden Orbitale mit (4 · 1 + 2 = 6) π-Elektronen. Gemäss der LCAO-Methode werden die Atomorbitale der beteiligten Atome „vermischt“ (rechnerische Linear-Kombinationen der Lösungen der Schrödinger-Gleichung). Sie spalten dabei sich in bindenende, nichtbindende und antibindene Molekülorbitale auf; die dann nach steigender Energie gemäß den bekannten Regeln (Hundt) aufgefüllt werden.
Frost und Musulin entwickelten ein grafisches Hilfsmittel zum Erkennen der Aromatizität von organischen Verbindungen, bekannt als Frost-Kreis[2] (engl. Frost’s Circle, benannt nach dem amerikanischen Chemiker Arthur A. Frost). Er schätzt die relativen Orbitalenergien für planare, monocyclische und vollständig konjugierte Moleküle dabei ab.
Inhaltsverzeichnis
Konstruktion der Frost-Kreises
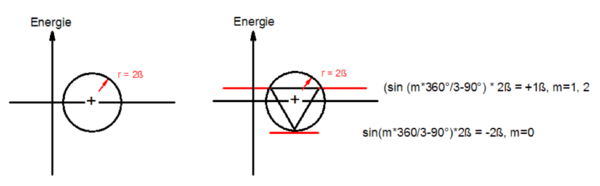
Um den n-Cyclus, gezeichnet mit einer Spitze nach unten, wird ein Umkreis gezeichnet. Den Radius dieses Kreises benennt Frost mit 2ß. Die relativen Orbitalenergien der Orbitale m = 0 − n ergeben sich dabei nach der Formel sin(m · 360°/n − 90°)· 2ß oder sin(m · 2 π/n − π/2)· 2ß.
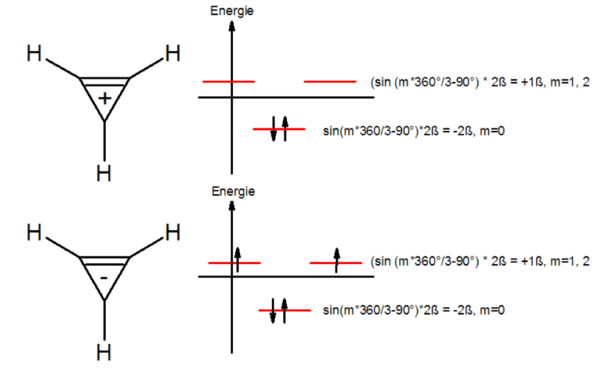
Beispiel Cyclopropenyl-Kation/Anion
Beginnend mit einem Energiediagramm wird ein Kreis mit dem Radius 2ß um die Abszisse gezogen. In diesen Kreis wird der n-Cyclus, eine Spitze nach unten eingeschrieben. Die Berührungspunkte n-Cyclus/Kreis geben die relataive Energie der Molekülorbitale wieder:
Nach Hückel sollte ein solches System aromatisch sein, wenn alle verfügbaren bindenden Orbitale doppelt besetzt sind (s.o).Das Cyclopropenylkation C3H3+ sollte aromatisch sein. Der Energiegewinnn ΔE durch die Delokalisierung beträgt 2e−·(−2ß) = −4ß. Für das Cyclopropenylanion C3H3− ergibt sich eine Diradikalstruktur, ΔE = ß + ß − 2ß = 0.
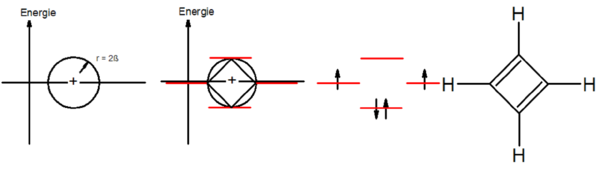
Beispiel Cyclobutadien
Bei Delokalisation der π-Elektronen würde sich eine Diradikalstruktur ergeben; Cyclobutadien ist nicht aromatisch.
Quellen
- ↑ Nguyên Trong Anh: Die Woodward-Hofmann-Regel und ihre Anwendung. Verlag Chemie, Weinheim, 1972. ISBN 3-527-25430-7
- ↑ A. A. Frost, B. Musulin: J. Chem. Phys. 21 (1953). S. 572
- ↑ Chemgapedia
- ↑ Chemgapedia
Wikimedia Foundation.