- Cyclobutadien
-
Strukturformel 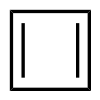
Allgemeines Name Cyclobutadien Andere Namen - 1,3-Cyclobutadien
- [4]Annulen
Summenformel C4H4 CAS-Nummer 1120-53-2 PubChem 136879 Eigenschaften Molare Masse 52,07 g·mol−1 Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cyclobutadien auch kurz CBD ist ein extrem instabiles Dien mit der Summenformel C4H4. In freier Form zerfällt es innerhalb von 5 Sekunden zu 1,3-Butadien. Cyclobutadien ist das kleinste Annulen und kann als solches nur bei tiefen Temperaturen in festen Matrizen aus inerten Gasen abgefangen werden, ohne dass es dimerisiert. Es ist ein cyclisches System mit konjugierten Doppelbindungen. Mit einer geraden Zahl von Elektronenpaaren ist es nach der Hückel-Regel ein Antiaromat und damit ein Diradikal mit niedriger Mesomeriestabilisierungsenergie. Deswegen ist es hochreaktiv und dimerisiert unter fast allen Bedingungen durch die Diels-Alder-Reaktion, die Reaktion findet selbst noch bei −78 °C statt. Dabei bildet sich bevorzugt das endo-Isomer, während das exo-Isomer nur als Nebenprodukt entsteht.[2]
Nach zahlreichen Fehlversuchen konnte es von Rowland Pettit 1965 zum ersten Mal an der Universität von Texas hergestellt werden, er konnte es jedoch nicht isolieren. Cyclobutadien kann durch Reduktion seiner Metallverbindungen hergestellt werden.
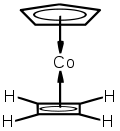
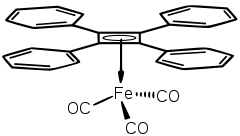
Cyclobutadien ist in vielen Metallkomplexen ein stabiler Ligand. Dies liegt darin begründet, dass zwei Elektronen vom Metall in Ligandenorbitale geschoben werden, wodurch ein hückelaromatisches 6π-Elektronensystem entsteht. CBD kann meist oxidativ (z. B. durch Cer(IV)-nitrat) vom Metallzentrum abgespalten werden.
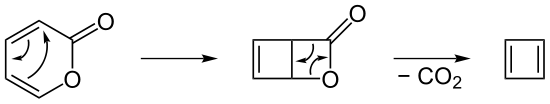
Cyclobutadien lässt sich nach Freisetzung aus den Metallkomplexen mit elektronenarmen Alkinen umsetzen. Es entsteht zuerst Dewar-Benzol, das sich daraufhin langsam zu einem Benzolderivat umlagert. Des Weiteren kann Cyclobutadien aus der Zersetzung von 2-Pyron erhalten werden. Nach dem thermisch kontrollierten Ringschluss wird durch CO2-Abspaltung das Dien erhalten.
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter Verlag, Berlin, 4. Auflage, 2011, S. 431, ISBN 978-3-11-024894-4.
Wikimedia Foundation.