- Natriumselenit
-
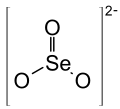
Strukturformel 
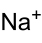
Allgemeines Name Natriumselenit Andere Namen Natriumselenat(IV)
Summenformel Na2SeO3 CAS-Nummer - 10102-18-8
- 26970-82-1 (Pentahydrat)
PubChem 24934 Kurzbeschreibung farb- und geruchloses, feuchtigkeitsempfindliches Pulver[1]
Eigenschaften Molare Masse 172,94 g·mol−1 Aggregatzustand fest
Dichte 3,95 g·cm−3[2]
Schmelzpunkt Löslichkeit gut in Wasser (950 g·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Gefahr
H- und P-Sätze H: 300-331-317-411 EUH: 031 P: 273-280 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 28-23-31-43-51/53 S: (1/2)-28-36/37-45-61 MAK 0,05 mg·m−3[1]
LD50 7 mg·kg−1 (oral, Ratte)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumselenit ist das Natriumsalz der Selenigen Säure (H2SeO3) mit der chemischen Formel Na2SeO3. Es liegt in Form nadelförmiger, weißer, hygroskopischer Kristalle vor.
Inhaltsverzeichnis
Vorkommen
Natriumselenit kommt natürlich in tierischem Gewebe vor.[4]
Gewinnung und Darstellung
Das Salz lässt sich durch Auflösen von Selendioxid in Natronlauge gewinnen, wobei die durch Reaktion des Selendioxids mit Wasser entstehende selenige Säure mit dem Natriumhydroxid zu Natriumselenit reagiert:[5]
Nettoreaktion:
Eigenschaften
Physikalische Eigenschaften
Die Standardbildungsenthalpie für festes Natriumselenit liegt bei −959 kJ/mol für das wasserfreie Salz bzw. bei −2404 kJ/mol für das Pentahydrat.[6]
Das Selenit-Ion ist pyramidal mit C3v-Symmetrie aufgebaut, der Abstand zwischen Sauerstoff- und Selenatom beträgt 1,74 Å.
Bei ca. 40 °C gibt das Pentahydrat sein Kristallwasser ab.
Chemische Eigenschaften
Aus Natriumselenit wird durch Reduktionsmittel sehr leicht rotes amorphes Selen abgespaltet.
Verwendung
Natriumselenit wird zur Rotfärbung von Glas und Porzellan (Reduktion zu rotem Selen), als Bestandteil von Fixierbädern und zur Prüfung der Keimfähigkeit von Saatgut verwendet. Weiterhin wird es in sehr geringer Konzentration (50–1000 µg) in der Medizin bei Selenmangelerscheinungen (Keshan-Krankheit), in der Krebstherapie und als Zusatzstoff in der Tierernährung eingesetzt. Des Weiteren dient es als Nachweisreagenz für Alkaloide.
In Schweden wird in Kunststoff eingebettetes Natriumselenit zur Fällung von Quecksilberionen als unlösliches Quecksilberselenid in Seen verwendet.
Sicherheitshinweise
Natriumselenit ist stark giftig, in der Kategorie 3B (Verdacht auf Krebs erzeugende Wirkung) bezüglich krebserregender Wirkung, und in der Kategorie C (kein Risiko bei Einhalten der Grenzwerte) bezüglich Leibesfruchtschädigung eingestuft.
Siehe auch
- Natriumselenid Na2Se
- Natriumselenat Na2SeO4
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 10102-18-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11.04.2008 (JavaScript erforderlich)
- ↑ a b MSDS Natriumselenit
- ↑ a b Eintrag zu CAS-Nr. 10102-18-8 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Natriumselenit bei MeriMed
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 431–2.
- ↑ G.H. Aylward, T.J.V. Findlay: Datensammlung Chemie in SI-Einheiten. 3. Auflage. Wiley-VCH, 1999, ISBN 3-527-29468-6.
Literatur
- A.F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin/New York 1995. ISBN 3-11-012641-9.
- Autorenkollektiv: Anorganikum. 5. Auflage. VEB Deutscher Verlag der Wissenschaften Berlin 1973.
- Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.1. Georg Thieme Verlag KG, Stuttgart 2008.
Kategorien:- Giftiger Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Natriumverbindung
- Selenverbindung
- Sauerstoffverbindung
Wikimedia Foundation.



