- Nickeloxydul
-
Kristallstruktur 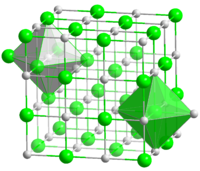
__ Ni2+ __ O2- Allgemeines Name Nickel(II)-oxid Andere Namen - Nickelmonoxid
- Nickeloxid (Achtung: mehrdeutig)
- Nickeloxydul (veraltet)
- Bunsenit (als Mineral)
Verhältnisformel NiO CAS-Nummer 1313-99-1 Kurzbeschreibung geruchloses, dunkelgrünes bis schwarzes Pulver [1] Eigenschaften Molare Masse 74,69 g/mol [1] Aggregatzustand fest
Dichte 7,45 g/cm3 [1]
Schmelzpunkt 1984 °C [1]
Löslichkeit Praktisch unlöslich in Wasser [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Giftig (T) R- und S-Sätze R: 49-43-53 S: 53-45-61 MAK Für krebserzeugende Stoffe wird generell kein MAK-Wert vergeben
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nickel(II)-oxid ist eine chemische Verbindung des Metalls Nickel, die zur Gruppe der Oxide gehört.
Inhaltsverzeichnis
Vorkommen
Natürlich kommt Nickel(II)-oxid als Mineral Bunsenit vor.
Gewinnung und Darstellung
Man erhält es durch starkes Calcinieren des Nitrats (Ni(NO3)2 oder Carbonats NiCO3 oder durch Oxidation von Rotnickelkies NiAs oder reinem Nickel an der Luft.
Eigenschaften
Nickel(II)-oxid ist ein basisches Oxid. Es ist antiferromagnetisch und hat eine Kristallstruktur ähnlich der von Natriumchlorid. Reinstes NiO ist hellgelb. Ein höherer Sauerstoffgehalt verleiht dem NiO eine grüne bis graugrüne Färbung. Dunklere bis schwarze Produkte enthalten zunehmend Ni3+.[3]
Verwendung
Nickel(II)-oxid wird zur Herstellung von Emaille (als Haftmittel[4]), Keramik, Gläsern (als Färbemittel) und Elektroden verwendet. Weiterhin dient es als Anodenmaterial in Brennstoffzellen.[5][6] Außerdem wird es als Katalysator für die Hydrierung organischer Verbindungen genutzt. Weiterhin ist es ein Zwischenprodukt zur Herstellung von reinem Nickel (Reduktion mit Kohlenmonoxid).
Sicherheitshinweise
Wie auch viele andere Nickelverbindungen wird Nickel(II)-oxid als krebserzeugend eingestuft.
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 1313-99-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1313-99-1 im European chemical Substances Information System ESIS
- ↑ Georg Brauer: Handbuch der Präparativen Anorganischen Chemie Band III, Ferdinand Enke Verlag Stuttgart 1981, ISBN 3-432-87823-0
- ↑ Mila Schrader: Gusseisenöfen und Küchenherde: Ein historischer Rückblick
- ↑ Institut für Energieforschung Jülich: Die Jülicher planare anodengestützte Hochtemperatur-Brennstoffzelle (SOFC)
- ↑ M. Pehnt: Ganzheitliche Bilanzierung von Brennstoffzellen in der Energie- und Verkehrstechnik
Siehe auch
- Nickel(III)-oxid, Ni2O3 (Nickelsesquioxid), CAS Nr: 1314-06-3
- Nickel(IV)-oxid, NiO2 (Nickeldioxid), CAS Nr: 12035-36-8
- Nickel(III)-oxidhydroxid, NiO(OH)
- Nickel(II)-hydroxid, Ni(OH)2, CAS Nr: 12054-48-7
Wikimedia Foundation.
