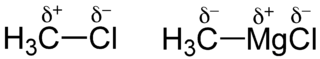- Partialladung
-
Unter Partialladung (lat. pars „Teil“, daher auch Teilladung) versteht man die unterschiedliche Ladung zweier Bindungspartner (Atome oder Molekülteile).[1]
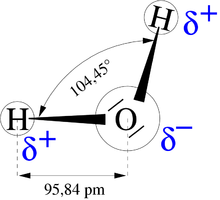
Unterscheiden sich die Bindungspartner einer Bindung in ihrer Elektronegativität, so ist die Verteilung der Bindungselektronen nicht mehr gleichmäßig, sondern es kommt zu einer Polarisation (unterschiedliche Ladung der Partner), die durch die Verschiebung der Ladungsträger (Elektronen) hervorgerufen wird. Diese Elektronenverschiebung bewirkt, dass die Bindungspartner teilweise (=partiell) positiv und negativ geladen sind.[1] Die Partialladung in einer XY-Bindung kann mit folgender Formel abgeschätzt werden:

Dabei steht GX für die Gruppennummer des Elements X, NX ist die Anzahl der nicht an der Bindung beteiligten Elektronen vom Atom X, BX ist die Anzahl der Elektronen, welche an der Bindung beteiligt sind und χX bzw. χY sind die Elektronegativitätswerte von X bzw. Y. So erhält man zum Beispiel für das Molekül HF: SF = − 0,29 und SH = 0,29, F ist also partial negativ und H partial positiv geladen.[2]
Je größer die Elektronegativitätsdifferenz (ΔEN) ist, desto größer wird der Grad der Polarisation und damit die Ausbildung der Partialladungen. Da zwischen unterschiedlichen Ladungen Bindungskräfte entstehen, werden diese umso größer, je größer der Ladungsunterschied ist. Ab einer bestimmten Größe der Differenz spricht man von einer Ionenbindung und Ionen.
Die Ladungen werden in chemischen Formal mit δ- und δ+ oberhalb des Elementes gekennzeichnet. Zu beachten ist, dass die Ladungen in dieser Form nicht wirklich existieren, da Ladungen nur Vielfache der Elektronenladung e sein können, sondern nur eine asymmetrischen Ladungsverteilung aufzeigen.[1]
Einzelnachweise
- ↑ a b c Harald Gärtner: Chemie: Formeln, Gesetze und Fachbegriffe. Compact, 2009, ISBN 978-3817478927 (Seite 178 in der Google Buchsuche).
- ↑ David Clark: General chemistry: pearls of wisdom. Jones & Bartlett Pub, 2004, ISBN 978-1890369224 (Seite 96 in der Google Buchsuche).
Wikimedia Foundation.