- Dipol-Molekül
-
Ein Molekül wird als Dipolmolekül oder kurz als Dipol bezeichnet, wenn es nach außen hin elektrisch neutral ist, die Elektronen aber innerhalb des Moleküls unsymmetrisch verteilt sind. Es bildet sich daher ein elektrischer Dipol aus, da die Schwerpunkte der positiven und der negativen Ladungen nicht örtlich zusammenfallen. Damit besitzt das Molekül eine Polarität mit einem positiven und einem negativen Pol. Der Grund für diese ungleichmäßige Ladungsverteilung sind polare Atombindungen, die durch die unterschiedliche Elektronegativität der Bindungspartner entstehen. Neben polaren Atombindungen tragen auch freie Elektronenpaare zur Polarität bei.
Das Produkt aus Ladungsdifferenz und Ladungsabstand bezeichnet man als Dipolmoment.
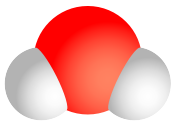
Das Wassermolekül ist das bekannteste Beispiel eines Dipol-Moleküls. Neben zwei polaren H-O-Bindungen tragen hier auch zwei freie Elektronenpaare zum Dipolmoment bei.
Allgemein kann gesagt werden, dass Moleküle mit einem asymmetrischen Aufbau und einer Differenz der Elektronegativitäten (ΔEN) kleiner 1,7 als Dipol erscheinen, d. h. sie sind zwar nach außen elektrisch neutral, haben aber ein Dipolmoment. Bei ΔEN größer 1,7 nimmt man ionischen Bindungscharakter an. Allerdings ist die Grenze ΔEN < 1,7 als Richtwert anzusehen.
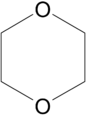
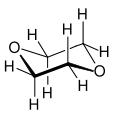
Kohlenstoffdioxid als Beispiel für ein symmetrisches Molekül mit ΔEN = 1,0 hat ebenfalls kein Dipolmoment. Dies liegt daran, dass Kohlendioxid ein lineares Molekül ist und sich die beiden partiellen Dipolmomente gerade kompensieren. Interessant ist die Situation beim symmetrisch scheinenden 1,4-Dioxan. Da der Sechsring des cyclischen Ethers jedoch nicht planar ist, weist das Molekül ein Dipolmoment von 0,45 D auf.
Wikimedia Foundation.