- Atomart
-
Ein Nuklid (von lat.: nucleus) ist in der Kernphysik eine Atomsorte, die durch ihre Massenzahl, Ordnungszahl und den Energiezustand des Atomkerns gekennzeichnet ist. Dadurch ist auch die Anzahl der Protonen und Neutronen im Kern festgelegt.
Zur Kurzbezeichnung eines Nuklids schreibt man links oben neben das Symbol des chemischen Elements die Massenzahl, links unten die Ordnungszahl, z. B.
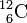 für das häufigste Kohlenstoff-Isotop. In früheren Zeiten wurde die Massenzahl rechts oben geschrieben. Die Ordnungszahl links unten kann weggelassen werden, da sie durch das Elementsymbol bereits eindeutig bestimmt ist.
für das häufigste Kohlenstoff-Isotop. In früheren Zeiten wurde die Massenzahl rechts oben geschrieben. Die Ordnungszahl links unten kann weggelassen werden, da sie durch das Elementsymbol bereits eindeutig bestimmt ist.Die verschiedenen Nuklide ein und desselben chemischen Elements, mit gleicher Zahl von Protonen aber unterschiedlichen Zahlen von Neutronen, werden als Isotope dieses Elements bezeichnet. Bis zur internationalen Einführung des Begriffs Nuklid (ca. 1950) wurde „Isotop“ inkorrekter- und verwirrenderweise auch in der allgemeinen Bedeutung Atomsorte gebraucht. Nuklide mit gleicher Massenzahl (Anzahl an Nukleonen), aber unterschiedlicher Ladung (Ordnungszahl) heißen Isobare: gleich schwer. Isotone sind Nuklide gleicher Neutronen- aber unterschiedlicher Protonenzahl.
Isomere sind Nuklide, deren Kerne sich bei gleicher Ladung und gleicher Massenzahl in einem unterschiedlichen inneren Zustand befinden. Instabile Nuklide sind radioaktiv und werden Radionuklide genannt.
Bezeichnung Charakteristikum Beispiele Bemerkungen Isotope gleiche Protonenzahl 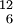 C ,
C , 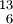 C
CIsotone gleiche Neutronenzahl 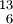 C ,
C , 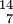 N
NIsobare gleiche Massenzahl 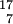 N ,
N , 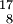 O ,
O , 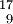 F
Fsiehe Betazerfall Spiegelkerne Neutronenzahl und Protonenzahl vertauscht  H ,
H ,  He
HeSpezialfall der Isobare Isodiaphere gleicher Neutronenüberschuss 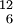 C,
C, 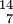 N
NIsomere Unterschiedliche innere Zustände 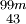 Tc
Tcnur langlebige Zustände In der Natur existieren rund 270 stabile und etwa 70 radioaktive Nuklide. Weit über tausend wurden künstlich erzeugt.
Die bekannten Nuklide werden in so genannten Nuklidkarten oder Isotopentabellen dargestellt.
Siehe auch
Weblinks
Wikimedia Foundation.
