- Chemisches Element
-
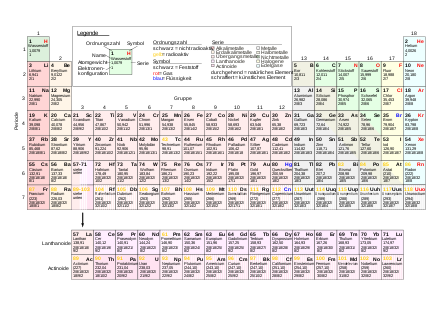
Chemisches Element ist die Sammelbezeichnung für alle Atomarten mit derselben Kernladungszahl (auch Ordnungszahl). Somit haben alle Atome eines chemischen Elements dieselbe Anzahl an Protonen im Atomkern. Ein Element wird durch ein Elementsymbol bezeichnet, eine Abkürzung, die meist vom lateinischen Namen des Elements (beispielsweise Pb von plumbum, Fe von ferrum) abgeleitet ist. Die Elemente werden im Periodensystem nach steigender Kernladungszahl angeordnet. Insgesamt gibt es 118 Elemente (Stand 2011)
Inhaltsverzeichnis
Geschichtliches
Begriffsgeschichte
Robert Boyle definierte 1661 ein chemisches Element als einen Reinstoff, der mit chemischen Methoden nicht weiter zerlegt werden kann (Boyle, The Sceptical Chymist) und verwendete somit den Begriff ganz anders als zuvor die Vier-Elemente-Lehre (Feuer, Wasser, Luft und Erde).
Der heutige Element-Begriff nimmt für die Stoffe eine Einteilung nach ihren Bestandteilen, den Atomen, vor. Er geht auf John Dalton und seine Atomhypothese zurück, ist abstrakter, dafür aber auch präziser. Seine praktische Bedeutung liegt darin, dass er Atome mit gleichem chemischen Verhalten bei chemischen Reaktionen zusammenfasst. Das sind Atome mit gleicher Protonenzahl. Mit den Stoffumwandlungen (auch als chemische Reaktion bezeichnet) der chemischen Elemente befasst sich die Chemie.
Entdeckungsgeschichte
In der Antike und bis weit ins Mittelalter war man der Auffassung, dass die Welt aus den vier Elementen Erde, Wasser, Luft und Feuer aufgebaut ist.
Von den Elementen im heutigen Sinne waren in der Antike nur wenige in Reinform bekannt, die entweder gediegen vorkamen oder aus Erz geschmolzen werden konnten: Kohlenstoff, Schwefel, Eisen, Kupfer, Zink, Silber, Zinn, Gold, Quecksilber und Blei. Im Laufe der mittelalterlichen Bergbaugeschichte wurden dann, vor allem im Erzgebirge, in Erzen geringe Mengen an Beimengungen unbekannter Metalle entdeckt und nach Berggeistern benannt (Cobalt, Nickel, Wolfram). Die Entdeckung des Phosphors 1669 durch Hennig Brand läutete schließlich das Zeitalter der Entdeckung der meisten Elemente ein, einschließlich des Urans aus Pechblende durch Martin Heinrich Klaproth 1789. Im Laufe des 19. Jahrhundert wurden die Metalle der Seltenen Erden entdeckt, womit fast alle natürlich vorkommenden Elemente bekannt waren. In dieser Zeit wurden auch viele hypothetische Elemente postuliert, die später wieder verworfen wurden so etwa das Nebulium. Im 20. und dem begonnenen 21. Jahrhundert wurden viele in der Natur nicht vorkommende Elemente – die Transurane – künstlich erzeugt, teils in Kernreaktoren, teils in Teilchenbeschleunigern. Allen diesen Elementen ist gemeinsam, dass sie instabil sind, d. h. dass sie sich unterschiedlich schnell in andere Elemente umwandeln. Mit der Entdeckung weiterer solcher kurzlebiger Elemente ist zu rechnen, sie entstehen jeweils in nur äußerst geringen Mengen. Ihren Namen erhielten die Elemente jeweils von ihrem Entdecker, was im 20. Jahrhundert zu einer Elementnamensgebungskontroverse führte. Elemente die noch nicht erzeugt oder benannt wurden tragen Systematische Elementnamen.
Ordnungssystem
Die Elemente ordnet man nach ihrer Kernladungszahl (Ordnungszahl) und der Elektronenkonfiguration ihrer Atome im Periodensystem der Elemente (PSE) in Gruppen und Perioden an. Dieses System wurde vom russischen Gelehrten Dmitri Iwanowitsch Mendelejew zeitgleich mit dem deutschen Arzt und Chemiker Lothar Meyer 1869 begründet.
Eigenschaften
Viele Grundeigenschaften chemischer Elemente lassen sich aus dem Aufbau ihrer Atome ableiten. Diverse, historisch gewachsene Atommodelle, wie das erfolgreiche Bohr'sche Schalenmodell liefern dazu die theoretischen Grundlagen.
Alle Atome eines Elements haben im elektrisch ungeladenen Zustand die der Protonenzahl entsprechende gleiche Anzahl Elektronen in den Elektronenhüllen. Bei der Anordnung der Elemente gemäß wachsender Protonenzahl beziehungsweise Ordnungszahl im sogenannten Periodensystem sind die Elemente zudem nach verwandten oder periodisch wiederkehrenden Eigenschaften (Schalenabschluss) gruppiert.
Bei chemischen Reaktionen werden nur die Elektronen auf den Außenschalen der Reaktionspartner umgeordnet, der Atomkern bleibt hingegen unverändert. Das Bestreben, Schalen durch Abgabe oder Aufnahme von Elektronen abzuschließen und damit relativ zu stabilisieren, dominiert über den elektrischen Ladungszustand eines Atoms. Beschrieben wird dieses Bestreben durch die Elektronegativität. Schalenabschlusszustand und Ladungszustand sind damit direkt mit dem chemischen Reaktionsvermögen eines Elements gekoppelt. Edelgase, Elemente mit abgeschlossener Schale im neutralen Zustand sind reaktionsarm, sie bilden nur unter drastischen Bedingungen Verbindungen. Atome suchen primär die sogenannte Edelgaskonfiguration (Schalenstabilität) zu erreichen, auch wenn das zu Lasten der elektrischen Neutralität geht, und streben sekundär nach Ladungsausgleich der Gesamtkonfiguration. Ein noch feineres Unterscheidungsschema zur eindeutigen Identifizierung der Elektronen eines Elements liefert das Quantenzahlenquartett: Hauptquantenzahl, Nebenquantenzahl, Magnetquantenzahl, Spinquantenzahl, also quantentheoretische Elementeigenschaften.
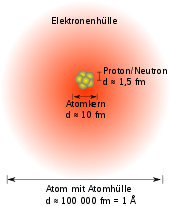
Weitere Eigenschaften der Elemente ergeben sich durch die Beachtung der Kernkonfigurationen eines Elementatoms. Kerne ein und desselben Elements können mit einer unterschiedlichen Anzahl an Neutronen bestückt sein. Diese nach der Anzahl der Neutronen verschiedenen Atome eines Elements heißen Isotope, abgeleitet von gr.: isos topos, was sinngemäß gleicher Platz (im Periodensystem) bedeutet. Isotope unterscheiden sich in der Masse und zeigen bei Kernreaktionen unterschiedliches Verhalten.
Identifiziert werden chemische Elemente über Nachweisreaktionen der Analytischen Chemie.
Masse
Die Atommasse der Elemente entspricht nicht genau dem Vielfachen der Masse des Wasserstoffatoms; Erklärungen dafür sind:
- Protonen und Neutronen, die den Hauptanteil der Masse bilden, sind fast, jedoch nicht genau gleich schwer.
- Bei sehr genauen Messungen zeigt sich die Bindungsenergie als Massendefekt, so dass die Kernmasse stets minimal kleiner ist als die Summe der Massen der Protonen und Neutronen.
Rein- und Mischelemente
Chemische Elemente, die nur eine Sorte von Atomen aufweisen, heißen Reinelemente, wenn sie dagegen aus zwei oder mehr Isotopen bestehen, heißen sie Mischelemente. Die meisten Elemente sind Mischelemente, nur 19 Elemente sind Reinelemente.
Vom Wasserstoff existieren beispielsweise drei Isotope: Protium (0 Neutronen), Deuterium (1 Neutron), Tritium (2 Neutronen). Der Kern des am häufigsten vorkommenden Wasserstoffnuklids (99,9851 % Protium) besteht aus einem Proton und ist neutronenfrei. Wasserstoff mit einem Proton und einem Neutron im Atomkern (Deuterium) tritt in natürlichem Wasserstoff nur mit einem Anteil von 0,0149 % auf, Tritium mit < 10-10 %.
Der Heliumatomkern besteht aus zwei Protonen und zwei Neutronen. Es existieren aber auch Helium-Atome, die zwei Protonen, aber nur ein Neutron enthalten. Diese treten in natürlichem Helium jedoch nur mit einem Anteil von 0,000137 % auf.
Chlor (17 Protonen) besteht aus einer Mischung aus Atomen mit 18 Neutronen (75,8 %) und 20 Neutronen (24,2 %).
Im Periodensystem steht für Mischelemente die durchschnittliche Atommasse gemäß relativer Häufigkeit der Isotope, die darüber hinaus um den Massendefekt korrigiert wird. Das natürliche Mischverhältnis ist bei einem Element meist gleich. Bei einigen Elementen kann die Isotopenzusammensetzung aber lokal schwanken. Blei zum Beispiel kann unterschiedliche durchschnittliche Atommassen aufweisen, je nachdem, aus welcher Lagerstätte es stammt. 2010 beschloss deshalb die IUPAC, dass zukünftig für die Elemente Wasserstoff, Bor, Lithium, Kohlenstoff, Stickstoff, Sauerstoff, Silicium, Schwefel, Chlor und Thallium ein Massenbereich im Periodensystem anzugeben ist[1].
Die Begriffe Reinstoff und Reinelement, sowie Stoffgemisch und Mischelement sind strikt zu unterscheiden.
Chemische Verbindungen
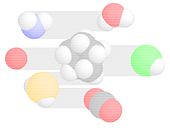 Kalottenmodelle für einige kleine Moleküle: Im Uhrzeigersinn, beginnend rechts in der Mitte: Chlorwasserstoff (HCl), Kohlendioxid (CO2), Schwefelwasserstoff (H2S), Neon (Ne), Aminogruppe (-NH2), Wasser (H2O); Mitte: Cyclopentan (C5H10)
Kalottenmodelle für einige kleine Moleküle: Im Uhrzeigersinn, beginnend rechts in der Mitte: Chlorwasserstoff (HCl), Kohlendioxid (CO2), Schwefelwasserstoff (H2S), Neon (Ne), Aminogruppe (-NH2), Wasser (H2O); Mitte: Cyclopentan (C5H10)
Chemische Elemente können, bis auf einige Edelgase, chemische Verbindungen eingehen. Dabei sind mehrere der elementaren Atome zu Molekülen oder Ionenkristallen zusammengeschlossen.
Elemente können eine Verbindung mit anderen Elementen oder auch mit sich selbst eingehen: Bei vielen Gasen wie Chlor Cl oder Fluor F verbinden sich zwei Atome desselben Elements untereinander zu einem Molekül, hierbei Cl2 und F2. Gewöhnliches Wasser (Summenformel: H2O) ist hingegen eine Verbindung aus den Elementen Wasserstoff H (2 Atome pro Molekül) und Sauerstoff (1 Atom pro Molekül).
Grundsätzlich gibt es drei Arten von chemischen Verbindungen zwischen den Atomen der Elemente:
- Molekulare Verbindungen entstehen aus Nichtmetall und Nichtmetall – sie sind Nichtleiter (elektrisch nicht leitfähig) mit zumeist relativ niedrigem Siedepunkt (diamantartige oder kunststoffartige Verbindungen mit Riesenmolekülen ausgenommen). Beispiele für molekulare Verbindungen sind neben Wasser auch Methan, Zucker).
- Ionische Verbindungen entstehen aus Metall(kation) und Nichtmetall(anion). Sie sind salzartig: spröde, oft von hohem Schmelzpunkt und in Schmelze oder Lösung elektrisch leitfähig. Beispiele für Ionenverbindungen sind Eisen(II)-oxid und Kochsalz (Natriumchlorid).
- Metallische Verbindungen entstehen aus zwei oder mehr Metallen. Die Metallatome sind hier durch metallische Bindung sowie nicht selten durch zusätzliche ionische oder kovalente Bindungsanteile verbunden. Sie sind nicht zu verwechseln mit Legierungen.
Die Entstehung von Elementen
 Gegen Ende ihrer Leuchtphase erzeugen schwere Sterne auch schwerere Atomkerne und stoßen das Material in Form von Wolken aus, hier: Nebel um den extrem massereichen Stern eta Carinae, entstanden durch Eruptionen 100 bis 150 Jahre zuvor.
Gegen Ende ihrer Leuchtphase erzeugen schwere Sterne auch schwerere Atomkerne und stoßen das Material in Form von Wolken aus, hier: Nebel um den extrem massereichen Stern eta Carinae, entstanden durch Eruptionen 100 bis 150 Jahre zuvor.
Bereits beim Urknall entstanden die leichten Elemente Wasserstoff (ca. 75 %) und Helium (ca. 25 %), zusammen mit geringen Mengen Lithium und Beryllium. Am Anfang der Kosmochemie steht daher der Wasserstoff mit einer relativen Atommasse von ca. 1,0 u (ein Proton). Schwerere Elemente entstehen im Universum durch Kernreaktionen in den Sternen. In Hauptreihen-Sternen, wie unserer Sonne, verschmelzen unter hoher Temperatur (mehrere Millionen Grad Celsius) und hohem Druck beispielsweise vier Wasserstoffatomkerne über mehrere Zwischenstufen zu einem Heliumatomkern (relative Atommasse ca. 4,0 u). Dieser ist ein wenig leichter als die vier Protonen zusammen, die Massendifferenz wird als Energie frei.
Diese Fusion (Atome mit geringerer Protonenzahl verschmelzen zu höheren) geht in den meisten Sternen bis zur Entstehung von Kohlenstoff, in massereichen bis zur Bildung von Eisen weiter, dem am dichtesten gepackten Atomkern. Dies erfolgt unter Abgabe von Energie, wobei die Energieausbeute mit zunehmender Ordnungszahl der gebildeten Elemente bis zum Eisen immer geringer wird, während für Fusionsreaktionen zu schwereren Kernen Energie benötigt würde.
Schwerere Elemente als Eisen entstehen deshalb nicht durch Kernfusion, sondern durch Neutroneneinfang bestehender Atome, die dabei in Elemente höherer Ordnungszahl umgewandelt werden. Dies geschieht bei massearmen Sternen im sogenannten s-Prozess, bei massereichen am Ende der Lebenszeit von Sternen während einer Supernova im r-Prozess.
Die entstandenen Elemente gelangen (kontinuierlich durch Sonnenwind oder explosiv in einer Supernova) in das interstellare Medium und stehen für die Bildung der nächsten Sterngeneration zur Verfügung. Jüngere Sternensysteme enthalten daher bereits von Anfang an geringe Mengen schwererer Elemente, die Planeten wie in unserem Sonnensystem bilden können.
Siehe auch: NukleosyntheseStatistik der chemischen Elemente
Von den 118 bekannten Elementen (Stand 2010) sind 80 stabil. Alle stabilen Elemente kommen auf der Erde natürlich vor, ebenso 14 radioaktive (siehe Elementhäufigkeit). Weitere radioaktive Elemente wurden künstlich hergestellt, ihre Zahl wird vermutlich weiter steigen.
Die Elemente lassen sich nach verschieden Kriterien unterteilen. Am häufigsten ist die Unterteilung in solche Elemente, die Metalle bilden und den Großteil der Elemente ausmachen, sowie in Nichtmetalle und die Zwischenstufe Halbmetalle.
Zur Gruppe der Nichtmetalle gehören nur 17 aller Elemente, diese bilden bei Standardbedingungen keine Metalle. Davon liegen die sechs Edelgase einatomig vor, weil deren Atome keine Moleküle bilden, d. h. nicht miteinander reagieren. Dagegen verbinden sich andere mit Atomen des gleichen Elements zu Molekülen. Dazu zählen die weiteren fünf unter Normalbedingungen gasförmigen Elemente: Wasserstoff (H2), Stickstoff (N2), Sauerstoff (O2), Fluor (F2) und Chlor (Cl2) sowie das flüssige Brom (Br2).
Siehe auch: Liste der chemischen ElementeHäufigkeit der chemischen Elemente
Die Häufigkeit der chemischen Elemente unterscheidet sich je nach dem betrachteten Bereich.
Im Universum ist sie eng verknüpft mit den Entstehungsprozessen im kosmologischen Zeitrahmen (Nukleosynthese). Dort ist das weitaus häufigste Element der Wasserstoff, gefolgt von seinem einfachsten Fusionsprodukt Helium, die beide schon bald nach dem Urknall entstanden. Die nächst häufigsten Elemente sind Kohlenstoff und Sauerstoff. Lithium, Beryllium und Bor entstanden ebenfalls beim Urknall, jedoch in wesentlich geringeren Mengen.
Helium, Kohlenstoff und Sauerstoff sowie alle anderen Atomsorten wurden durch Kernfusion in Sternen oder andere astrophysikalische Vorgänge gebildet. Dabei entstanden häufiger Atome mit gerader Protonenzahl, wie Sauerstoff, Neon, Eisen oder Schwefel, während Elemente mit ungerader Protonenzahl seltener sind. Diese Regel wird nach dem US-amerikanischen Chemiker William Draper Harkins (1873–1951) Harkinssche Regel genannt. Markant ist die besondere Häufigkeit des Eisens als Endpunkt der möglichen Kernfusion in Sternen.
Die Verteilung auf der Erde unterscheidet sich von derjenigen, die im gesamten Universum vorherrscht. Insbesondere sind auf der Erde vergleichsweise geringe Mengen Wasserstoff und Helium vorhanden, weil diese Gase vom Schwerefeld der Erde nicht festgehalten werden können; im Sonnensystem befinden sie sich vor allem in den Gasplaneten wie Jupiter und Neptun. Auf Gesteinsplaneten wie der Erde überwiegen die schwereren Elemente, vor allem Sauerstoff, Silicium, Aluminium und Eisen.
Organismen bestehen hauptsächlich aus Wasserstoff, Sauerstoff, Kohlenstoff und Stickstoff.
In dem jeweils betrachteten Bereich sehr häufig vorkommende Elemente bezeichnet man als Mengenelemente, sehr seltene als Spurenelemente.
Siehe auch: Liste der Häufigkeiten chemischer ElementeAnhang
Belege
- ↑ Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure and Applied Chemistry. 2010, S. 1, doi:10.1351/PAC-REP-10-09-14.
Literatur
- Lucien F. Trueb: Die chemischen Elemente – Ein Streifzug durch das Periodensystem. S. Hirzel Verlag, Stuttgart 2005, ISBN 3-7776-1356-8
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
Weblinks
 Commons: Chemisches Element – Album mit Bildern und/oder Videos und Audiodateien
Commons: Chemisches Element – Album mit Bildern und/oder Videos und Audiodateien Wiktionary: chemisches Element – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: chemisches Element – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen Wikibooks: Wikijunior Die Elemente – Lern- und Lehrmaterialien
Wikibooks: Wikijunior Die Elemente – Lern- und Lehrmaterialien- www.chemieseite.de enthält ausführliche Beschreibungen der Hauptelemente
- www.pse-mendelejew.de enthält viele Fotografien von Reinelementen
- www.pse.merck.de enthält eine reiche Auswahl an atomaren Eigenschaften in einer interaktiven Tabelle
Wikimedia Foundation.