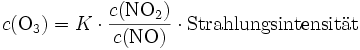- Photosmog
-
Als Sommersmog (auch Photosmog, Ozonsmog oder L.A.-Smog) bezeichnet man die Belastung der bodennahen Luft durch eine hohe Ozonkonzentration. Er tritt bei wärmerem Wetter auf und entsteht aus Stickoxiden und Kohlenwasserstoffen in Verbindung mit der UV-Strahlung der Luft. Bodennahes Ozon greift die Atmungsorgane an und schädigt Pflanzen und Tiere. Die Ozonbelastung der Umwelt wird durch Luft-Messstationen ermittelt und regelmäßig in Belastungskarten dargestellt und veröffentlicht.
Inhaltsverzeichnis
Entstehung
Das bodennahe Ozon entsteht unter Mitwirkung von Stickstoffoxiden und wird durch die Sonnenstrahlung beeinflusst. Stickstoffdioxid wird durch UV-Strahlung in Stickstoffmonoxid und ein Sauerstoffatom gespalten. Dieser atomare Sauerstoff verbindet sich mit einem Sauerstoff-Molekül zu Ozon:
NO2 + Licht( λ < 420 nm) → NO + O
O + O2 → O3
Gleichzeitig baut Stickstoffmonoxid (NO) Ozon unter Bildung von Stickstoffdioxid und Sauerstoff wieder ab:
NO + O3 → NO2 + O2
Die Ozonkonzentration c(O3) ist also abhängig von der Stickstoffdioxidkonzentration, der Stickstoffmonoxidkonzentration und der Strahlungsintensität:
Mit K als Gleichgewichtskonstante.
Die Bildung von Ozon wird außerdem durch Kohlenwasserstoffe begünstigt, da diese unter Sonneneinwirkung Stickstoffmonoxid zu Stickstoffdioxid umwandeln:
O3 + UV-Strahlung → O2 + O
O + H2O → 2HO•
HO• + R-CH3 → R-CH2• + H2O
R-CH2• + O2 → R-CH2O-O•
R-CH2O-O• + NO → R-CH2O• + NO2
R-CH2O• + O2 → R-CHO + HO-O•
HO-O• + NO → NO2 + •OH
Das OH-Radikal wirkt also katalytisch und wird nicht verbraucht. In der Gesamtbilanz ergibt sich:
R-CH3 + 2O2 + 2NO → RCHO + 2NO2 + H2O
Ozonbildungspotential
Die beispielsweise von einem Fahrzeug mit Verbrennungsmotor emittierten Abgase tragen mit den unterschiedlichen Reaktivitäten ihrer Bestandteile (VOC) zur Ozonbildung in der bodennahen Troposphäre bei. Dabei haben insbesondere ungesättigte Kohlenwasserstoffe eine hohe Reaktionsfreudigkeit mit HO-Radikalen und dementsprechend ein hohes Ozonbildungspotential.
Ozon ist Hauptbestandteil des photochemischen Smog (Sommersmog), der hauptsächlich durch Verkehrswesen, Industrie und Haushalte verursacht wird
Maßstab für die Bewertung des Ozonbildungspotentials ist eine Anfang der 90er in den USA entwickelte Methode, bei der im Rahmen des gesetzlich vorgeschriebenen Fahrzyklustests (z.B. US-FTP) die Abgasbestandteile einzeln erfasst und bewertet werden. In Kalifornien wird dieses Verfahren inzwischen bei der Zertifizierung neuer auf dem Markt zugelassener Fahrzeuge - insbesondere bei solchen mit reformulierten und alternativen Kraftstoffen - herangezogen.
Dies erfolgt mit Hilfe der MIR-Skala (maximum incremental reactivity), welche die Betrachtung relativer Ozonbildungspotentiale unter bestimmten atmosphärischen Bedingungen ermöglicht. MIR-Faktoren wurden mittlerweile für etwa 200 Abgaskomponenten empirisch ermittelt.
Komponenten mit den höchsten Reaktivitäten sind einige Olefine (MIR = 8-11 gO3/gVOC), einige Aromaten (7-9 gO3/gVOC) sowie einige Oxigenate (Aldehyde mit 5-7 gO3/gVOC); die niedrigste Reaktivität hat Methan mit 0,015 gO3/gVOC.
Fahrzeugversuche haben folgendes ergeben:
- Das Ozonbildungspotential wird durch einen Katalysator um 80-95% gegenüber einem katalysatorlosen Fahrzeug reduziert
- Sehr günstig liegt ein mit Erdgas (CNG) betriebenes Fahrzeug
- Nur geringe Unterschiede ergeben sich dagegen zwischen anderen Kraftstoffen (Benzin, Diesel, Alkoholkraftstoffe M85/E85)
- Im Benzinbetrieb werden 50% des Ozonbildungspotentials von nur 4 Abgaskomponenten gebildet, folgende 40% dagegen von 16 weiteren Komponenten
- Im Gas- (CNG) und Dieselbetrieb werden 50% des Ozonbildungspotentials von jeweils nur 2 Komponenten gebildet
- Ebenso werden im Alkoholbetrieb (M85/E85) 50% des Ozonbildungspotentials von jeweils nur 2 Komponenten gebildet (Formaldehyd bzw. Acetaldehyd, unverbrannter Alkohol), folgende 40% dagegen von 18 weiteren Komponenten
Weitere Ozonquellen
Laserdrucker, Photokopierer und Faxgeräte setzen Ozon durch Entladung frei. Auch durch Blitze entsteht Ozon.
Auswirkungen beim Menschen
Die Geruchsschwelle von Ozon liegt bei 40,2 µg/m³, allerdings gewöhnt man sich schnell an den Geruch und nimmt ihn dann nicht mehr wahr.
Ozon dringt als Reizgas tief in die Lunge ein und kann Entzündungen hervorrufen. Je nach Dauer der Belastung und der Konzentration gibt es gesundheitliche Auswirkungen wie:
- Husten
- Augenreizung
- Kopfschmerzen
- Lungenfunktionsstörungen
Nach Empfehlungen von Ärzten sollten körperliche Anstrengungen bei hohen Ozonwerten vermieden werden.
Gesetzliche Grenzwerte
Nach der 3. EU Richtlinie 2002/3/EG für "Grenzwerte zum Schutze der Gesundheit" gilt:
- 1-h-Konzentration > 180 μg/m3: Information der Bevölkerung
- 1-h-Konzentration > 240 μg/m3: Warnung der Bevölkerung
- max. Tagesbelastung (8-h-Wert): 120 μg/m3
Mögliche Gegenmaßnahmen
Individuell hilft (kurzfristig) die Vermeidung durch Aufsuchen geschlossener Räume oder das Verlassen belasteter Gegenden. Eine langfristige Verminderung gelingt nur auf kollektiver Ebene. Da das Wetter als einer der Auslöser als weitgehend unbeeinflussbar gesehen wird, zielen die Maßnahmen zur Verminderung des Sommersmogs auf die Verminderung von Stickoxiden und flüchtigen Kohlenwasserstoffen ab. Da diese durch Verkehr, private Feuerungsanlagen und Industrie / Gewerbe verursacht werden, helfen (kurzfristig) Anlagenabschaltung und Verkehrsvermeidung. Langfristig sind die Nachrüstung und/oder der Austausch von Anlagen und Fahrzeugen erforderlich.[1][2][3][4]
Bitte beachte den Hinweis zu Gesundheitsthemen! Literatur/Quellen
- Chemie heute - Sekundarbereich II, Schrödel Verlag
- C.E. Mortimer, U. Müller: Chemie, 8. Aufl., Thieme, Stuttgart, 2003
- B. Höhlein, P. Biedermann et al.: Verkehrsemissionen und Sommersmog, Monographien des Forschungszentrum Jülich, Band 26/1996, ISBN 3-89336-188-X
- G. Decker, J. Beyersdorf et al.: Das Ozonbildungspotential unterschiedlicher Fahrzeug- und Kraftstoffkonzepte, ATZ Automobiltechnische Zeitschrift 98(1996)5
- ↑ NRW-Landtag 1985
- ↑ http://muenster.org/august/deutsch/d_projekte/98_99_9d/ozon.htm
- ↑ Linke Münster
- ↑ Vorlesungsskript der Zürcher ETH 1992
Siehe auch
Weblinks
Wikimedia Foundation.