- Stickstoffmonoxid
-
Strukturformel 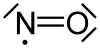
Allgemeines Name Stickstoffmonoxid Andere Namen - Stickstoffoxid
- Stickoxid
Summenformel NO CAS-Nummer 10102-43-9 PubChem 145068 ATC-Code R07AX01
DrugBank DB00435 Kurzbeschreibung Eigenschaften Molare Masse 30,01 g·mol−1 Aggregatzustand gasförmig
Dichte 1,25 kg·m−3 (15 °C, 1 bar)[3]
Schmelzpunkt Siedepunkt −152 °C[3]
Löslichkeit 60 mg·l−1 in Wasser (20 °C)[3]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [2] 



Gefahr
H- und P-Sätze H: 330-270-314-280 EUH: 071 P: 260-280-244-220-304+340-303+361+353-305+351+338-370+376-315-405-403 [2] EU-Gefahrstoffkennzeichnung [3] 


Brand-
förderndSehr giftig Ätzend (O) (T+) (C) R- und S-Sätze R: 8-26-34 S: 9-17-26-28-36/37/39-45 MAK 30 mg·m−3[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Stickstoffmonoxid ist ein farbloses und giftiges Gas mit der Formel NO. Es ist eine chemische Verbindung aus den Elementen Stickstoff und Sauerstoff und gehört zur Gruppe der Stickoxide.
Inhaltsverzeichnis
Eigenschaften
Das Stickstoffmonoxid hat eine molare Masse von 30,01 g/mol, der Schmelzpunkt liegt bei −163,6 °C, der Siedepunkt bei −151,8 °C. Die kritische Temperatur für NO beträgt −93 °C und der kritische Druck liegt bei 6,4 MPa. In Wasser ist Stickstoffoxid wenig löslich. Unter Einwirkung von Sauerstoff und anderen Oxidationsmitteln wird NO sofort zu braunem Stickstoffdioxid oxidiert, das in Wasser zu Salpetersäure und Salpetriger Säure disproportioniert. Außer mit Iod reagiert es mit Halogenen zu Nitrosylhalogeniden, wie z.B. Nitrosylchlorid. Unter Einwirkung von Schwefeldioxid wird Stickstoffoxid zu Distickstoffoxid reduziert.
Es ist schleimhautreizend, und durch die Bildung von Methämoglobin wirkt Stickstoffmonoxid toxisch. Die Ausbildung der Methämoglobinämie beruht auf einer Reaktion von HbO2 mit NO selbst, wobei Nitrat und Methämoglobin entstehen, sowie auf der Reaktion mit aus NO entstandenem Nitrit.[7]
Herstellung
Labortechnisch kann NO durch Reduktion von etwa 65-prozentiger Salpetersäure mit Kupfer gewonnen werden. Das Produkt ist aber relativ unrein. Reines Stickstoffmonoxid ist zugänglich:[9]
- aus einer Lösung von Kaliumnitrit und Kaliumiodid in Wasser, in die Schwefelsäure getropft wird:

- Statt Kaliumiodid kann auch Kaliumhexacyanoferrat(II) verwendet werden:
![\mathrm{KNO_2 + K_4[Fe(CN)_6] + H_2SO_4 \longrightarrow NO + K_3[Fe(CN)_6] + K_2SO_4 + H_2O}](0/a607e83067de2a818767f1fb5c38a609.png)
- aus Nitrosylhydrogensulfat und Quecksilber
- aus Natriumnitrit und Schwefelsäure:
- aus Eisen(II)-sulfat und einer Mischung von Natriumbromid und Natriumnitrit. Das Endprodukt dieser einfachen Reaktion enthält 98,8% NO und 1,2% N2.
Industriell wird das Gas durch die katalytische Ammoniakverbrennung (Ostwald-Verfahren) gewonnen. Früher wurde das Gas großtechnisch auch durch sogenannte Luftverbrennung von Stickstoff und Sauerstoff in einem elektrischen Lichtbogen gewonnen. Die verwendeten Verfahren (Birkeland-Eyde-Verfahren, Schönherr-Verfahren, Pauling-Verfahren) zielten auf einen möglichst kurzen Kontakt der Gase mit dem sehr heißen Flammbogen ab, um so das Reaktionsgleichgewicht zum Stickstoffmonoxid zu verschieben. Da hierbei sehr viel elektrische Energie benötigt wird, sind die Verfahren nicht konkurrenzfähig zum Ostwaldverfahren und werden nicht mehr eingesetzt.
Verwendung
Technisch
Stickstoffoxid tritt als Zwischenprodukt bei der technischen Herstellung von Salpetersäure auf und wird zusammen mit Stickstoffdioxid zu Herstellung von Nitriten verwendet. Reinstes Stickstoffmonoxid wird als Prüfgas zur Kalibrierung von Messgeräten eingesetzt.
Medizinisch
Stickstoffmonoxid hat eine erweiternde Wirkung auf die Blutgefäße der Lunge.
Das Gasgemisch INOmax des Herstellers Linde AG wurde 1999 durch die Food and Drug Administration (FDA) in den USA[10] und 2001 durch die Europäische Kommission in der EU[11] zugelassen für die Behandlung von Neugeborenen mit Lungenversagen mit hohem Blutdruck in der Lunge (hypoxisch respiratorische Insuffizienz, „Lungenhochdruck“). Es ist weltweit das erste medizinische Gas, das als Arzneimittel zugelassen wurde und enthält 100, 400 oder 800 ppm (0,01 %, 0,04 % oder 0,08 %) Stickstoffmonoxid als wirksamen Bestandteil, der Rest ist inerter Stickstoff. INOmax wird als komprimiertes Gas in Aluminium-Gasflaschen vertrieben. Zur Anwendung wird es der Atemluft zugesetzt, die empfohlene Dosis liegt bei 20 ppm.[11][12]
Stickstoffmonoxid wirkt sehr schnell, wodurch lebensbedrohliche Komplikationen gut behandelt werden können. In der Herzchirurgie (Klappenerkrankungen, Herztransplantationen) kann NO verwendet werden um einen erhöhten pulmonalen Druck zu behandeln. Ein Wert von NO für die Behandlung des ARDS, einer schweren Lungenfunktionsstörung, die nach Lungenverletzungen, -entzündungen und Reizgasverätzungen auftreten kann, ist zweifelhaft.[13][14] Ferner wird NO bei bestimmten Operationen am Gehirn älterer Menschen eingesetzt.
Physiologische Bedeutung
Stickstoffmonoxid ist ein bioaktives Molekül, das mit anderen Molekülen sowohl Redoxreaktionen als auch additive Reaktionen eingehen kann. Aufgrund seiner geringen Größe kann es in kurzer Zeit biologische Membranen durchqueren und lokal verschiedene Funktionen ausüben, von denen ein Teil destruktiv für den jeweiligen Organismus ist. Lediglich bei Archaeen ist fraglich, ob Stickstoffmonoxid eine biologische Funktion hat. Diese reicht in Tieren von der Signaltransduktion im Gefäß- und Nervensystem bis zur Rolle als reaktive Stickstoffspezies in der unspezifischen Immunabwehr. Auch in Pflanzen werden mehrere Prozesse über NO-Signale gesteuert. Auf der destruktiven Seite ist die Schädigung von Proteinen und DNA zu nennen, die mit chronischem Entzündungsgeschehen in Säugetieren und daraus folgender lokaler NO-Produktion einhergeht.[15]
Geschichte
Ende der 1970er-Jahre wurde der Pharmakologe Ferid Murad erstmals auf die physiologischen Wirkungen des Stickstoffmonoxid (NO) aufmerksam. Bei Untersuchungen mit organischen Nitraten – einer Substanzgruppe, die bei akuten Brustschmerzen eingesetzt wird – entdeckte er, dass diese NO freisetzen, welches eine Erweiterung (Vasodilatation) der Blutgefäße bewirkt. Auch der Pharmakologe Robert F. Furchgott untersuchte die Auswirkungen von Medikamenten auf die Blutgefäße. Er fand heraus, dass die innerste Gefäßschicht (Endothel) eine unbekannte Substanz (Faktor) produziert, die in der darunterliegenden Muskelschicht deren Erschlaffung (Relaxierung) herbeiführt. Da er die Substanz nicht bestimmen konnte, nannte er sie EDRF (Endothelium-derived relaxing Factor, von dem Endothel stammender, Gefäßmuskulatur-erschlaffender Faktor). Erst im Laufe der 1980er Jahre gelang es, die unbekannte Substanz EDRF zu entschlüsseln. Unabhängig voneinander identifizierten Louis J. Ignarro und Robert F. Furchgott EDRF als Stickstoffmonoxid.
1998 wurde der Nobelpreis für Physiologie und Medizin an die Amerikaner Robert Furchgott, Ferid Murad und Louis J. Ignarro verliehen. Den Forschern gelang es erstmals, die große Bedeutung des NO für die Blutversorgung von Organen und dessen Rolle als Botenstoff im Organismus nachzuweisen. Mit den Erkenntnissen über NO erschließen sich somit neue Möglichkeiten bei der Behandlung von Gefäßerkrankungen und den dadurch bedingten Organschäden.
Biosynthese
NO wird unter Verbrauch von NADPH durch NO-Synthasen (NOS) aus der Aminosäure L-Arginin und Sauerstoff hergestellt. Als weitere Endprodukte entstehen dabei Citrullin und Wasser. Es sind heute vier NOS-Isoformen identifiziert, von denen die endotheliale NOS (eNOS) und die neuronale NOS (nNOS) konstitutiv exprimiert werden, während die induzierbare NOS-Isoform (iNOS) auf transkriptioneller Ebene induzierbar ist. Alle vier Isoformen haben eine hohe Sequenz-Homologie zur Cytochrom P450-Reduktase und sind in spezifischen Zelltypen lokalisiert.
Physiologische Anpassung
Tibeter verfügen als Anpassung an das Leben im Hochland um 4000 Meter über zehnmal so viel NO im Blut wie Bewohner auf 200 Meter über dem Meeresspiegel, was zu einer Verdoppelung des Blutflusses im Vergleich zu Tiefland-Bewohnern führt und hierdurch zu einer optimierten Versorgung mit Sauerstoff.[16]
Einzelnachweise
- ↑ a b Sicherheitsdatenblatt (air liquide)
- ↑ a b c Eintrag zu CAS-Nr. 10102-43-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. April 2011 (JavaScript erforderlich).
- ↑ a b c d e Sicherheitsdatenblatt (praxair)
- ↑ British Journal of Anesthesia. Vol. 39, Pg. 393, 1967.
- ↑ Naunyn-Schmiedeberg's Archiv für Experimentelle Pathologie und Pharmakologie. Vol. 181, Pg. 145, 1936.
- ↑ Gigiena Truda i Professional'nye Zabolevaniya. Labor Hygiene and Occupational Diseases. Vol. 19(4), Pg. 52, 1975.
- ↑ [1] Aktivität und Bedeutung der erythrozytären NOS bei kardiovaskulären Risikofaktoren, Patrick Horn
- ↑ [2] Nitrat in Lebensmitteln, Martin Ledig und Georg Wittke
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 485-7.
- ↑ FDA Approval, Review March 2001 (englisch)
- ↑ a b Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation zu INOmax auf der Website der Europäischen Arzneimittelagentur
- ↑ Fachinformation für USA (englisch)
- ↑ N.K. Adhikari et. al.: Effect of nitric oxide on oxygenation and mortality in acute lung injury: systematic review and meta-analysis. British Medical Journal 2007 Apr 14;334(7597):779. PMID 17383982
- ↑ H.R. Bream-Rouwenhorst et. al.: Recent developments in the management of acute respiratory distress syndrome in adults. American Journal of Health System-Pharmacy 2008 Jan 1;65(1):29-36. PMID 18159036
- ↑ M. V. Beligni, L. .. Lamattina: Nitric oxide in plants: the history is just beginning. In: Plant, Cell and Environment. 24, 2001, S. 267–278, doi:10.1046/j.1365-3040.2001.00672.x.
- ↑ S. C. Erzurum u.a.: Higher blood flow and circulating NO products offset high-altitude hypoxia among Tibetans. PNAS 104, November 2007, S. 17593–17598, doi:10.1073/pnas.0707462104

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-R07
- Brandfördernder Stoff
- Ätzender Stoff
- Giftiger Stoff
- Stickstoffverbindung
- Neurotransmitter
- Second Messenger
- Arzneistoff
- Oxid
- Radikal (Chemie)
Wikimedia Foundation.


