- Protolysegrad
-
Der Dissoziationsgrad α (auch Protolysegrad) gibt das Verhältnis der durch Dissoziation gelösten Säure- bzw. Base-Teilchen zur Gesamtkonzentration der Säure-/Base-Teilchen der Lösung an. Er lässt sich zum Beispiel aus der Senkung des Gefrierpunktes der Lösung gegenüber dem Lösungsmittel experimentell bestimmen.
Der Dissoziationsgrad ist konzentrationsabhängig. Die gelösten Ionen werden von den Lösungsmittelmolekülen entsprechend ihrer Dielektrizitätskonstanten ε abgeschirmt, man spricht hier auch von Hydratation. Diese Abschirmung wirkt den starken Anziehungskräften zwischen unterschiedlich geladenen Ionen entgegen. Mit zunehmender Anzahl an Ionen wird die Hydratation schwächer, weil im Verhältnis zu den gelösten Ionen weniger Lösungsmittelmoleküle zur Verfügung stehen. In Lösungsmitteln mit hohen Dielektrizitätskonstanten (z. B. Wasser ε = 78,54) werden daher höhere Dissoziationsgrade erreicht als in Lösungsmitteln mit niedrigen Dielektrizitätskonstanten (z. B. Vakuum ε = 1, Essigsäure ε = 6,20).
Dissoziationsgrad bei Säuren
Für eine einwertige Säure HA welche gemäß der Gleichung
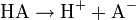 dissoziert gilt:
dissoziert gilt: ![\alpha=\frac{[\mathrm{A^-}]}{c_0}](/pictures/dewiki/48/06e65d445aec7d9ea8be452e47bfb5ab.png) .
.α gibt also den relativen Anteil an dissozierter Säure an. Der relative Anteil an nicht dissozierter Säure α' ergibt sich aus:
![\alpha'=\frac{[\mathrm{HA}]}{c_0}=1-\alpha](/pictures/dewiki/54/6fbc717c5b145782317cd50a367233fd.png) .
.Die Kombination des Massenwirkungsgesetzes für das Protolysegleichgewicht mit der Massenerhaltung der Säure in der Lösung (c0 = [A − ] + [HA] bzw. α + α' = 1) führt zu folgenden Ausdruck für den Dissoziationsgrad:
![\alpha=\mathrm\frac{K_S}{[H^+]+K_S}](/pictures/dewiki/98/b0fab928f9712bc1e53529ee911736e8.png)
Die Definition eines Dissoziationsgrades für Basen ist nicht eigens erforderlich, da er bereits in α enthalten ist.
Wikimedia Foundation.
