- Tetramminkupfersulfat
-
Strukturformel 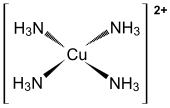
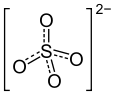

Allgemeines Name Tetramminkupfersulfat Summenformel Cu(NH3)4SO4 · H2O CAS-Nummer 10380-29-7 Eigenschaften Molare Masse 245,75 g·mol−1 Aggregatzustand fest
Dichte 1,81 g·cm−3[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] Monohydrat

Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [1] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37/39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tetraamminkupfer(II)-sulfat [Cu(NH3)4]SO4 ist ein Komplexsalz des zweiwertigen Kupfers und der Schwefelsäure. Als Feststoff liegt es als Monohydrat [Cu(NH3)4]SO4 · H2O vor. Die tiefblaue Farbe der Salzkristalle entsteht durch den Tetraamminkomplex [Cu(NH3)4]2+ des Kupfers, der in wässriger Lösung durch zwei weitere Wassermoleküle komplexiert wird. Das an Luft langsam zu einem grünen Pulver verwitternde Salz hat einen Zersetzungspunkt von ca. 150 °C.
Tetraamminkupfer(II)-sulfat entsteht durch Versetzen einer wässrigen Kupfer(II)-sulfat-Lösung mit Ammoniak im Überschuss:
Der Farbumschlag von blassblau zu tiefblau kann zum Nachweis der Kupferionen dienen. Auf Bildung des Tetraamminkupferkomplexes beruht auch die Verwendung von Kupfersalzen als Geheimtinte.
Obwohl die Tetraammin-kupfer(II)-salze stabile Komplexsalze sind, ist dieser Komplex nicht so stark, dass keine Reaktion mit Schwefelwasserstoff (H2S) möglich ist. Bei der Zugabe von Schwefelwasserstoff (H2S) wird schwarzes Kupfer(II)-sulfid ausgefällt. Die aus dem Gleichgewicht des Komplexes resultierende Kupfer(II)-ionenkonzentration[2] entsprechend der Gleichung
ist höher als die max. Lösungskonzentration des Kupfer(II)-sulfids. Deshalb wird trotz der Komplexverbindung Kupfer(II)-sulfid ausgefällt.
Bei der Zugabe von Kalkmilch zu einer Lösung von Tetraamminkupfer(II)-sulfat bildet sich ein blaugrüner Niederschlag. Dieses Farbpigment, auch als Kalkblau oder Neuwieder Blau[3] bezeichnet, wird für Malerfarben verwendet.Einzelnachweise
- ↑ a b c d Datenblatt Tetraamminecopper(II) sulfate monohydrate bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Jander-Wendt: Lehrbuch der analytischen und präparativen anorganischen Chemie, 3. Auflage, S. Hirzel Verlag, Sttg., 1959, S. 243.
- ↑ Brockhaus der Naturwissenschaften und der Technik, 4. Auflage, S. F.A.Brockhaus Verlag, Wiesbaden, 1958, S. 325.
Wikimedia Foundation.

![\mathrm{CuSO_4 + 4 \ NH_3 + H_2O \longrightarrow \ {[Cu(NH_3)}_{4}]SO_4 \cdot \ H_2O}](b/c6b50ac0c5248fec5694c111347354b8.png)
![\mathrm{[Cu(NH_3)_4]^{\,2+}\rightleftharpoons\ Cu^{\,2+} + 4 \ NH_3}](9/909366ff00d3a5ae9eb7211323fa500e.png)