- Thymidilat-Synthase
-
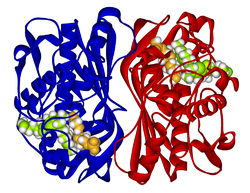
Thymidylat-Synthase Bändermodell des Thymidylat-Synthase-Dimer, komplexiert mit dem Inhibitor Raltitrexed (Kalotten) nach PDB 1HVY Vorhandene Strukturdaten: 1hvy, 1hw3, 1hw4, 1hzw, 1i00, 1ju6, 1juj, 1ypv, 2onb Größe 313 aa; 35,7 kDa Struktur Homodimer Bezeichner Gen-Namen TYMS; TS; HsT422; MGC88736; TMS; TSase Externe IDs OMIM: 188350 MGI: 98878 Enzymklassifikation EC, Kategorie 2.1.1.45 Transferase Reaktionsart Reduktive Methylierung Substrat dUMP + 5,10-Methylentetrahydrofolat Produkte dTMP + Dihydrofolat Vorkommen Übergeordnetes Taxon Lebewesen Orthologe Mensch Maus Entrez 7298 22171 Ensembl ENSG00000176890 ENSMUSG00000025747 UniProt P04818 Q544L2 Refseq (mRNA) NM_001071 NM_021288 Refseq (Protein) NP_001062 NP_067263 Genlocus Chr 18: 0.65 - 0.66 Mb Chr 5: 30.39 - 30.4 Mb PubMed Suche [1] [2] Thymidilat-Synthase ist ein Enzym der Biosynthese von dTMP (d für Desoxynukleotide; TMP für Thymidinmonophosphat) das Uracil in Form von Uridinmonophosphat methyliert. Die Anwesenheit ausreichender Mengen dTMP ist notwendig für die DNA-Reparatur und ihre Replikation. Das Enzym ist daher Target für Zytostatika wie Fluoruracil und Raltitrexed, die es hemmen. Resistenz gegen diese Medikamente tritt in Personen auf, die einen Überschuss des Enzyms produzieren. TYMS konkurriert mit dem Enzym MTHFR, das Homocystein zu Methionin umwandelt, um den Kofaktor Methylen-Tetrahydrofolat.[1]
Inhaltsverzeichnis
Synthese
Das für TYMS kodierende Gen ist in allen Eukaryoten zu finden. Es erstreckt sich beim Menschen in 6 Exons über 15 Kilobasen auf Chromosom 18. Das Protein ist 313 Aminosäuren lang und 35,7 kDa schwer.[2]
Katalysierte Reaktion
(Siehe Bild) Die Synthese von dTMP (1b) aus dUMP (1a) wird durch die Thymidylat-Synthase (A) katalysiert. Die Methylgruppe stammt aus N5,N10-Methylentetrahydrofolat (2), das zu 7,8-Dihydrofolat (3) umgesetzt wird. Beim Rest R1- handelt es sich um 1-(2-Desoxy-β-D-ribofuranosyl)-, und -R2 ist -benzoylglutaminsäure.
Einzelnachweise
Weblinks
Wikimedia Foundation.