- Pyrimidinbase
-
Strukturformel 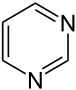
Allgemeines Name Pyrimidin Andere Namen - 1,3-Diazin
- Abkürzung: Y (Pyrimidin)
Summenformel C4H4N2 CAS-Nummer 289-95-2 Kurzbeschreibung farblose bis orangefarbene Verbindung [1] Eigenschaften Molare Masse 80,09 g·mol−1 Aggregatzustand fest bis flüssig
Dichte 1,02 g·cm−3 (20 °C) [1]
Schmelzpunkt 19 °C [1]
Siedepunkt 123–124 °C [1]
Löslichkeit mischbar mit Wasser, Alkohol und Ether [2]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: 10 S: 16 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Pyrimidin ist eine sechsgliedrige heterocyclische aromatische organische Verbindung mit zwei Stickstoffatomen, die auch als 1,3-Diazin bezeichnet wird. Pyrimidine sind neben Purine wichtige Bausteine der Nucleinsäuren. Der Name leitet sich von gr. pyr = Hitze, Feuer (wegen der Verwandtschaft zu Pyridin) und der Stoffklasse der Amidine ab, da es 1885 von Ernst Ludwig Pinner (1885–1911) aus Acetessigester und einem Amidin erstmals synthetisiert wurde.
Inhaltsverzeichnis
Struktur
Pyrimidin zählt als ein Aza-Analoges (Azalog) des Pyridins zu den Diazinen.
Abgeleitete Moleküle
Pyrimidine
Übersicht
Werden die Wasserstoff-Atome in den Positionen 2, 4, 5 und 6 durch andere Atomgruppen ersetzt, ergeben sich verschiedene substituierte Pyrimidine:
Pyrimidine Name Grundstruktur R2 R4 R5 R6 Cytosin 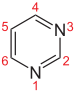
=O –NH2 –H –H Uracil =O =O –H –H Thymin =O =O –CH3 –H Barbitursäure =O =O –H =O Orotsäure =O –COOH –H =O Tautomerie
Aufgrund der Molekülabschnitte mit dem Grundmuster N=C–X–H (mit X = O, S oder NH) besteht die Möglichkeit der Tautomerie.
Pyrimidinderivate
Von den Pyrimidinen leiten sich formal die Stoffklassen der Flavine, Pteridine und Purine ab. Auch in den Vitaminen Thiamin und Riboflavin sind Pyrimidine als Bausteine enthalten.
Biologische Bedeutung
- Sind Cytosin und Uracil in Position 1 mit dem 1. C-Atom der Ribose verknüpft, ergeben sich die Nucleoside Cytidin und Uridin. Durch Veresterung der Ribose mit Phosphat entstehen die Nucleotide CMP und UMP, die Bausteine der RNA sind. Enthält das Nucleotid Cytosin oder Thymin und Desoxyribose, handelt es sich um die Bausteine der DNA, Desoxy-Cytidin- (dCMP) und Desoxy-Thymidinmonophosphat (dTMP).
- Durch Salpetrige Säure (HNO2) wird die Amino-Gruppe des Cytosins in eine Hydroxylgruppe umgewandelt. Dadurch entsteht aus Cytosin Uracil. Wirkt Salpetrige Säure auf die DNA (als Mutagen) ein, führt diese Änderung dazu, dass es bei der Vermehrung der DNA (Reduplication) zu fehlerhaften Basenpaarungen und damit zu einer veränderten Basensequenz kommt, die zu veränderten Proteinen und damit zu einem veränderten Phänotyp führen kann.
Biochemie
Biosynthese
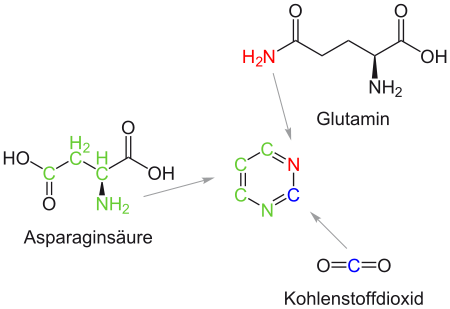
Anders als bei den Purinen wird der heterozyklische Ring unabhängig von der Ribose aufgebaut und erst nach Fertigstellung mit dem Zucker verknüpft. Als Zwischenprodukt dieser Synthesekette erscheint die Orotsäure, das Endprodukt ist das Uridinmonophosphat (UMP), welches in weiteren Schritten zu CMP, dUMP, dCMP und dTMP umgebaut wird.
Die Produktion von Pyrimidinen im Körper erfolgt im Cytosol und beginnt mit der Bildung von Carbamoylphosphat aus Glutamin, 2 ATP und HCO3− zu Carbamoylphosphat + 2 ADP + Pi + Glutamat. Anschließend katalysiert das Enzym Aspartat-Carbamyl-Transferase die Bildung von N-Carbamoylaspartat aus Carbamoylphosphat und Aspartat. Daraus wird dann der Ring gebildet: N-Carbamoylaspartat zyklisiert unter Abspaltung von Wasser zu Dihydroorotat, das durch erneute Abspaltung von Wasser zu Orotat wird. Aus dem freien Pyrimidin Orotat werden dann die Pyrimidinnucleotide synthetisiert.
Abbau der Basen
Von den Nucleosiden und Nucleotiden werden als erstes die Basen abgespalten. Diese werden zu β-Alanin oder 3-Aminoisobutyrat abgebaut.
Medizinische Bedeutung
- Von der Barbitursäure leiten sich viele am 5. Kohlenstoffatom substituierte Moleküle, die Barbiturate, ab, die als Schlafmittel Verwendung finden.
- Wird die Synthese des Thymidins gestört, wirkt sich das auch als Störung der DNA-Synthese aus. Eine wirksame Möglichkeit ist die Hemmung der Thymidilat-Synthase durch 5-Fluoruracil, das sich vom Thymin dadurch unterscheidet, dass es an der Stelle der Methylgruppe ein Fluoratom aufweist. Damit steht ein wirksames Krebs-Medikament zur Verfügung. Allerdings wirkt sich die Störung der Zellteilung auch auf andere sich schnell vermehrende Zellen in den Haarfollikeln und im Knochenmark aus, was die schweren Nebenwirkungen bei einer Chemotherapie erklärt.
- Pyrimidin-Derivate spielen auch als Diuretika, Antibiotika, Antimetabolika und in der antiviralen Therapie eine Rolle.
Quellen
- ↑ a b c d e Eintrag zu Pyrimidin in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 13. April 2008 (JavaScript erforderlich)
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1374, ISBN 978-0-911910-00-1.
Weblinks
Wikimedia Foundation.