- Δ-Aminolävulinsäure-Dehydratase
-
Δ-Aminolävulinsäure-Dehydratase —
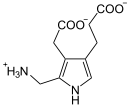
Vorhandene Strukturdaten: 1E51, 1PV8 Größe 330 Aminosäuren Struktur Homooctamer Kofaktor Zn2+ Bezeichner Gen-Namen ALAD; ALADH; PBGS Externe IDs OMIM: 125270 UniProt: P13716 MGI: 96853 Enzymklassifikation EC, Kategorie 4.2.1.24 Lyase Reaktionsart Kondensation Substrat 2 δ-Aminolävulinsäure Produkte Porphobilinogen + 2 H2O Vorkommen Homologie-Familie 5-ALAD Übergeordnetes Taxon Euteleostomi δ-Aminolävulinsäure-Dehydratase (ALAD) oder auch Porphobilinogen-Synthase ist der Name des Enzyms in vielen Lebewesen, das zwei Moleküle δ-Aminolävulinsäure (ALA) zu einem Molekül Porphobilinogen zusammenbaut. Es ist damit ein unverzichtbarer Teil der Porphyrinbiosynthese, jener Teil des menschlichen Stoffwechsels, der den Blutfarbstoff Hämoglobin herstellt. Ein Mangel an ALAD beim Menschen, der durch Mutation am ALAD-Gen hervorgerufen wird, führt zur Porphyrie. Der Gehalt an ALAD im Blut ist erniedrigt bei Bleivergiftung.[1][2]
Jede der acht identischen Untereinheiten des Enzyms bindet als Kofaktor ein Zinkion. In einem ähnlichen Pflanzenenzym ist Zink durch Magnesium ersetzt.[3]
Katalysierte Reaktion
Zwei ALA-Moleküle kondensieren zu Porphobilinogen.
Einzelnachweise
Weblinks
Wikimedia Foundation.