- δ-Aminolävulinsäure-Dehydratase
-
Δ-Aminolävulinsäure-Dehydratase —
Vorhandene Strukturdaten: 1E51, 1PV8 Masse/Länge Primärstruktur 330 Aminosäuren Sekundär- bis Quartärstruktur Homooctamer Kofaktor Zn2+ Bezeichner Gen-Namen ALAD; ALADH; PBGS Externe IDs OMIM: 125270 UniProt: P13716 MGI: 96853 Enzymklassifikation EC, Kategorie 4.2.1.24 Lyase Reaktionsart Kondensation Substrat 2 δ-Aminolävulinsäure Produkte Porphobilinogen + 2 H2O Vorkommen Homologie-Familie 5-ALAD Übergeordnetes Taxon Euteleostomi δ-Aminolävulinsäure-Dehydratase (ALAD) oder auch Porphobilinogen-Synthase ist der Name des Enzyms in vielen Lebewesen, das zwei Moleküle δ-Aminolävulinsäure (ALA) zu einem Molekül Porphobilinogen zusammenbaut. Es ist damit ein unverzichtbarer Teil der Porphyrinbiosynthese, jener Teil des menschlichen Stoffwechsels, der den Blutfarbstoff Hämoglobin herstellt. Ein Mangel an ALAD beim Menschen, der durch Mutation am ALAD-Gen hervorgerufen wird, führt zur Porphyrie. Der Gehalt an ALAD im Blut ist erniedrigt bei einer Bleivergiftung,[1][2] als Folge tritt ein erhöhter Spiegel von ALA in Blut und Urin auf.[3]
Jede der acht identischen Untereinheiten des Enzyms bindet als Kofaktor ein Zinkion. In einem ähnlichen Pflanzenenzym ist Zink durch Magnesium ersetzt.[4]
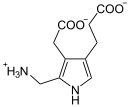
Katalysierte Reaktion
Zwei ALA-Moleküle kondensieren zu Porphobilinogen.
Einzelnachweise
- ↑ UniProt-Eintrag
- ↑ Δ-Aminolävulinsäure-Dehydratase bei Online Mendelian Inheritance in Man.
- ↑ Jan Koolman, Klaus-Heinrich Röhm: Taschenatlas der Biochemie. 3. Auflage, Georg Thieme Verlag, 2003, ISBN 978-3-13759403-1, S. 192.
- ↑ PROSITE PDOC00153
Weblinks
- Jassal, D'Eustachio / reactome: ALA is transported from the mitochondrial matrix to the cytosol
- Jassal, D'Eustachio / reactome: Two molecules of ALA condense to form porphobilinogen (PBG)
- Jassal, D'Eustachio / reactome: ALAD octamer associates with Pb++, forming a catalytically inactive complex
Wikimedia Foundation.