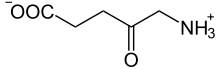
- 5-Aminolävulinsäure
-
Strukturformel 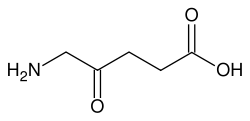
Allgemeines Name 5-Aminolävulinsäure Andere Namen - δ-Aminolävulinsäure
- 5-Amino-4-oxopentansäure (IUPAC)
- 5-ALA
- Levulan (Handelsname des Arzneimittels)
Summenformel C5H9NO3 CAS-Nummer - 106-60-5
- 5451-09-2 (Hydrochlorid)
PubChem 137 ATC-Code L01XD04
DrugBank DB00855 Kurzbeschreibung weißer Feststoff[1]
Eigenschaften Molare Masse 131,13 g·mol−1 Aggregatzustand fest
Schmelzpunkt - 118–119 °C[2]
- 156–158 °C (Hydrochlorid, Zersetzung)[2]
Löslichkeit gut in Wasser[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [3] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze [3] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 5-Aminolävulinsäure ist eine chemische Verbindung, genauer eine Aminosäure aus der Gruppe der Ketocarbonsäuren.
Inhaltsverzeichnis
Gewinnung und Darstellung
Außer durch chemische Verfahren kann 5-Aminolävulinsäure auch durch biotechnologische Verfahren mit Hilfe von Bakterien (Rhodobakterium, Propionibakterium, Methanobakterium, Methanosarcina und ähnlichen) hergestellt werden.[4]
Biologische Bedeutung
5-Aminolävulinsäure ist eine Vorstufe des Häm in der Porphyrinsynthese. Hierbei reagieren zwei Moleküle unter Abspaltung von Wasser zu Porphobilinogen:
Das Ion δ-Aminolävulinat entsteht in einer durch das mitochondriale Enzym δ-Aminolävulinatsynthase katalysierten Reaktion aus Succinyl-CoA und der Aminosäure Glycin:
- Succinyl-CoA + Glycin → δ-Aminolävulinat + CO2 + CoA
Das benötigte Succinyl-CoA entstammt dem Citratzyklus, Glycin der Biosynthese aus Serin. Im weiteren Verlauf der Hämbiosynthese reagieren zwei Moleküle δ-Aminolävulinat zum sogenannten Porphobilinogen (PBG) und zwei Wassermolekülen. Diese Reaktion wird vom Enzym δ-Aminolävulinsäure-Dehydratase (synonym: Porphobilinogen-Synthase) katalysiert.
- 2 δ-Aminolävulinat → PBG + 2 H2O
Das entstehende Porphobilinogen wird dann vom Mitochondrium ins Zytosol transportiert.
Verwendung
5-Aminolävulinsäure reichert sich in Tumorzellen deutlich stärker als in unveränderten Zellen an. Dieser Effekt wird in der Photodynamischen Therapie (PDT) ausgenutzt. Nach Umwandlung in Protoporphyrin kann Lichtenergie aufgenommen und auf Sauerstoff übertragen werden, der dadurch zum sehr reaktiven Singulett-Sauerstoff wird und das Tumorgewebe, in dem das Protoporphyrin bevorzugt gebildet wurde, spezifisch zerstört.
Die intrazelluläre Anreicherung im bösartigen Hirntumor Glioblastom und dortige Umwandlung in einen lachsrot fluoreszierenden Metaboliten ermöglicht intraoperativ eine bessere Abgrenzung des Tumorrandes zum angrenzenden Hirngewebe und erleichtert hierdurch die Tumorresektion.[5]
Bei einer akuten Bleivergiftung gilt ein erhöhter Spiegel der 5-Aminolävulinsäure im Urin als empfindliches Nachweisverfahren.[6][7]
5-Aminolävulinsäure wird auch als Düngemittel in der Landwirtschaft eingesetzt.[8]
Einzelnachweise
- ↑ a b c Sicherheitsdatenblatt (Biosynth), abgerufen am 30. April 2009.
- ↑ a b Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Datenblatt 5-Aminolevulinic acid hydrochloride bei Sigma-Aldrich, abgerufen am 18. März 2011.
- ↑ Mikroorganismen, welche 5-Aminolävulinat herstellen und Verfahren zur Herstellung von 5-Aminolävulinat unter Verwendung derselben (Patent-de).
- ↑ Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol 2006; 7: 392–401.
- ↑ Jan Koolman, Klaus-Heinrich Röhm: Taschenatlas der Biochemie. 3. Auflage, Georg Thieme Verlag, 2003, ISBN 978-3-13-759403-1, S. 192.
- ↑ Rainer Braun: Spezielle Toxikologie für Chemiker: eine Auswahl toxischer Substanzen. Vieweg+Teubner Verlag, 1999, ISBN 978-3-519-03538-1, S. 38.
- ↑ 5-Aminolävulinsäure als Düngemittel (Pentakeep).
Weblinks
- Kubisches Gel und Pflaster: Konkurrierende Darreichungsformen für 5-Aminolävulinsäure
- Daniela Steinat: Bewertung der Photodynamischen Diagnostik mit 5-Aminolävulinsäure beim Basalzellkarzinom durch 3-D-Histologie

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-L01
- Reizender Stoff
- Arzneistoff
- Orphan-Arzneimittel
- Aminosäure
- Ketocarbonsäure
- Stoffwechselintermediat
Wikimedia Foundation.