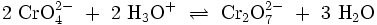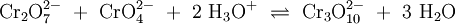- Bichromat
-
Chromate 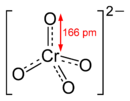
Chromat-Anion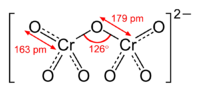
Dichromat-Anion
Kaliumchromat-Kristalle
Kaliumdichromat-KristalleChromate sind Salze der Chromsäure (H2CrO4). Das Chromat-Anion CrO42− hat eine gelbe Farbe und eine tetraedrische Struktur. Das Dichromat-Anion (Cr2O72−) hat eine orange Farbe und ist aus zwei verzerrten, eckenverknüpften Tetraedern aufgebaut. Zwischen Chromaten und Dichromaten besteht in wässrigen Lösungen ein pH-abhängiges chemisches Gleichgewicht:
Unter sehr sauren Bedingungen und konzentrierten Lösungen bilden sich in einer analogen Reaktion die eher rötlichen Trichromate (Cr3O102−), Tetrachromate (Cr4O132−) und tiefrote Polychromate (CrnO3n+12−).
Alle Chromate sind – besonders unter sauren Bedingungen – starke Oxidationsmittel.
Verwendung und Sicherheitshinweise
Chromate finden teilweise Verwendung als Korrosionsschutzmittel (Pigmente, siehe auch Rostumwandler). Viele Chromate haben eine intensive Färbung, deshalb werden (oder wurden) sie als farbgebender Bestandteil in Malerfarbe verwendet, beispielsweise „Chromgelb“ (PbCrO4). Chromate finden Verwendung in der analytischen Chemie. Alle Chromate und andere Chrom(VI)-verbindungen (mit Ausnahme des wasserunlöslichen Bariumchromats) sind stark giftig, wassergefährdend und krebserzeugend; Beispiele sind etwa Kaliumdichromat, Natriumchromat, Zinkchromat und Chrom(III)-chromat.
Siehe auch
Weblinks
- Prof. Blumes Bildungsserver für Chemie: Das Chromat-Dichromat-Gleichgewicht
Wikimedia Foundation.