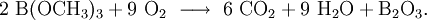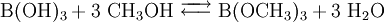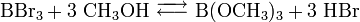- Borsäuretrimethylester
-
Strukturformel 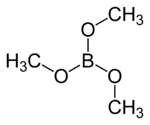
Allgemeines Name Trimethylborat Andere Namen - ortho-Borsäure-trimethylester
- Trimethoxyborin
Summenformel C3H9BO3 CAS-Nummer 121-43-7 Kurzbeschreibung farblose Flüssigkeit von charakteristischen Geruch Eigenschaften Molare Masse 103,91 g/mol Aggregatzustand flüssig
Dichte 0,915 g·cm−3[1]
Schmelzpunkt -34 – -29 °C[1]
Siedepunkt 67-69 °C[1]
Dampfdruck 182hPa[1] (25 °C)
Löslichkeit unbegrenzt mischbar mit Ethanol, Methanol, mit Wasser Zersetzung
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 10-21 S: (2)-23-25 LD50 6140 mg/kg[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Trimethylborat (Borsäuretrimethylester) ist der Methylester der Borsäure.
Inhaltsverzeichnis
Eigenschaften
Trimethylborat ist eine farblose, flüchtige Flüssigkeit. In Wasser wird sie zügig in Borsäure und Methanol hydrolysiert. Sie ist der einfachste Borsäureester. Als Verbindung des Bors brennt sie mit kräftig hellgrün gefärbter Flamme. Weil keine C-C-Bindungen vorliegen, entsteht bei der Verbrennung kein Ruß, der in der Flamme gelb glüht und so die Flammenfärbung übertönt (eine große Ethanolflamme hat bereits eine gelbliche Flamme, Alkane brennen mehr oder weniger hell). Bei der Verbrennung entsteht nicht flüchtiges, weißes Bortrioxid, das Säureanhydrid der Borsäure, welches die Flamme rauchen lässt:
Herstellung
Trimethylborat entsteht durch Veresterung von Borsäure mit Methanol in Gegenwart saurer Katalysatoren in einer Gleichgewichtsreaktion:
Zur Verschiebung des Gleichgewichtes auf die rechte Seite ist es jedoch nötig, dem Reaktionsgemisch eines der Produkte zu entziehen (Prinzip von Le Chatelier). Die sich bei Veresterungen häufig anbietende Methode ist die Bindung des Wassers durch wasserentziehende Mittel wie beispielsweise Schwefelsäure, welche gleichzeitig als saurer Katalysator wirkt.
Die Umsetzung von Bortrioxid führt zur Bildung eines Gemisches verschiedener Borsäureester.
Eine dritte Möglichkeit besteht in der Umsetzung von Borhalogeniden mit Methanol in Gegenwart einer Base wie im folgenden Beispiel mit Bortribromid:
Der entstehende Halogenwasserstoff (im Beispiel Bromwasserstoff) wird durch die Base gebunden.
Verwendung
Reines Trimethylborat findet technisch wenig Anwendung. Es dient in geringem Maße zur Oberflächenvergütung von Stahl (Bildung einer korrosionshemmenden Fe2B-Schicht) in speziellen Plasmaverfahren. Trimethylborat findet als Ausgangssubstanz für Borsäure-Edukte der Suzuki-Kupplung Verwendung. Weiterhin wird Trimethylborat als Flussmittel zum Löten in sogenannten "Gasflux"-Verfahren eingesetzt.
Die durchgehend grüne Flammenfärbung des Esters kann analytisch als Indiz für die Anwesenheit von Borsäure/Boraten bzw. Methanol (die Borsäureester höherer Alkohole liefern nur grüne Flammensäume) dienen, ist jedoch nicht eindeutig. Sie ist jedoch sehr empfindlich und wird schon durch Spuren von Borsäure verursacht (zum Beispiel aus dem häufig in Laboren verwendeten Borosilicatgläsern stammend).
Quellen
Wikimedia Foundation.