- Borax
-
Borax Borax-Kristalle aus Kalifornien Chemische Formel Na2[B4O5(OH)4] · 8 H2O[1] Mineralklasse Borate (früher: Carbonate, Nitrate und Borate)
6.DA.10 (8. Auflage: V/H.10-30) (nach Strunz)
26.04.01.01 (nach Dana)Kristallsystem monoklin Kristallklasse monoklin-prismatisch  [2]
[2]Farbe farblos, weiß, grau, gelb, grün Strichfarbe weiß Mohshärte 2 bis 2,5 Dichte (g/cm3) 1,7 bis 1,72 [2] Glanz Glasglanz bis matt Transparenz durchsichtig bis undurchsichtig Bruch muschelig Spaltbarkeit vollkommen Habitus kurze, prismatische oder tafelige Kristalle, säulige, erdige, körnige, massige Aggregate Kristalloptik Brechungsindex α=1,447 β=1,469 bis 1,470 γ=1,472 [3] Doppelbrechung
(optische Orientierung)Δ=0,025 [3] ; 39° bis 40°, zweiachsig negativ [3] Pleochroismus farblos [2] Weitere Eigenschaften Schmelzpunkt 878 °C Chemisches Verhalten in Wasser und Glycerin löslich Ähnliche Minerale Kernit, Colemanit, Sassolin, Soda, Trona Borax, auch als Tinkal, Natriumborat oder unter seiner chemischen Bezeichnung Dinatriumtetraborat-Decahydrat[4] bekannt, ist ein in der Natur selten vorkommendes Mineral aus der Mineralklasse der „Borate“ (früher: „Carbonate, Nitrate und Borate“, siehe Klassifikation). Es kristallisiert im monoklinen Kristallsystem mit der chemischen Formel Na2[B4O5(OH)4] · 8 H2O [1] und entwickelt meist kurze, prismatische oder tafelige Kristalle, aber auch erdige, körnige oder massige Aggregate von meist weißer oder grauer Farbe. Gelegentlich ist es auch farblos.
Inhaltsverzeichnis
Besondere Eigenschaften
Beim Erhitzen verliert es bei etwa 100 °C einen Teil seines Kristallwassers und bildet ein Pentahydrat. Oberhalb von 400 °C erhält man wasserfreies Natriumtetraborat, das bei 878 °C schmilzt. Die molare Masse von Natriumtetraborat beträgt 201,22 g·mol−1, die des Decahydrats 381,37 g·mol−1. Die Dichte der wasserfreien Substanz ist 2,37 g·cm−3, die des Decahydrats 1,72 g·cm−3 [4].
Etymologie und Geschichte
Borax wurde zuerst 1748 durch den schwedischen Mineralogen Johan Gottschalk Wallerius beschrieben. Der Name leitet sich von dem arabischen Wort bauraq für „weiß“ ab.[2] Es wurde schon in der Antike in China für Glasuren und in Ägypten zum Einbalsamieren benutzt.
In den Vereinigten Staaten entdeckte der Chemiker John Allen Veatch das erste Vorkommen von Borax am 8. Januar 1856. Im September desselben Jahres gelangte er zum kalifornischen Borax Lake. [5]
Klassifikation
In der mittlerweile veralteten, aber noch gebräuchlichen 8. Auflage der Mineralsystematik nach Strunz gehörte der Borax zur gemeinsamen Mineralklasse der „Carbonate, Nitrate und Borate“ und dort zur Abteilung der „Gruppenborate“, wo er zusammen mit Diomignit und Tincalconit eine eigenständige Gruppe bildete.
Die seit 2001 gültige und von der IMA verwendete 9. Auflage der Strunz'schen Mineralsystematik ordnet den Borax in die mittlerweile eigenständige Klasse der „Borate“ und dort in die Abteilung der „Tetraborate“ ein. Diese Abteilung ist allerdings weiter unterteilt nach der Art der Kristallstruktur, so dass das Mineral entsprechend seines Aufbaus in der Unterabteilung „Insel(Neso)-Tetraborate“ zu finden ist, wo es als einziges Mitglied die unbenannte Gruppe 6.DA.10 bildet.
Die Systematik der Minerale nach Dana ordnet den Borax, wie die veraltete Strunz'sche Systematik, in die Klasse der „Carbonate, Nitrate und Borate“ und dort in die Abteilung der „Hydratisierten Borate mit Hydroxyl oder Halogen“ ein. Hier ist er einziges Mitglied in der unbenannten Gruppe 26.04.01 innerhalb der Unterabteilung der „Hydratisierten Borate mit Hydroxyl oder Halogen“.
Bildung und Fundorte
 Boraxknolle aus dem Death Valley
Boraxknolle aus dem Death Valley
 Borax, zur Hälfte umgewandelt in Pseudomorphosen von Tincalconit nach Borax
Borax, zur Hälfte umgewandelt in Pseudomorphosen von Tincalconit nach Borax
Borax kommt in der Natur in kristalliner oder massiver Form ähnlich wie Anhydrit oder Gips als Evaporit vor, entsteht also bei der Austrocknung von Salzseen, die dann auch Boraxseen genannt werden, und tritt dann als Sediment auf. Daneben findet man es auch in vulkanischen Schloten.
Weltweit konnte Borax bisher (Stand: 2010) an rund 60 Fundorten nachgewiesen werden, so unter anderem an der „Loma Blanca Borat-Lagerstätte“ (Coranzuli, Jujuy) und in der „Tincalayu Mine“ (Salta) in Argentinien, am Salar de Challviri in der bolivianischen Provinz Sur Lípez, am Chabyêr Caka Salzsee (Tibet) in China, in der indischen Region Ladakh, bei Larderello in der italienischen Provinz Pisa, bei Pachuca de Soto in Mexiko, in der Sankaya Borat-Lagerstätte bei Kırka in der Türkei, auf der Halbinsel Kertsch in der Ukraine, sowie bei Boron, am Borax Lake, am Searles Lake und im Death Valley in Kalifornien (USA).[3]
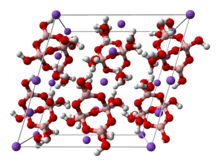
Kristallstruktur
Borax kristallisiert monoklin in der Raumgruppe C2/c mit den Gitterparametern a = 11,89 Å; b = 10,65 Å; c = 12,21 Å und β = 106,6° sowie 4 Formeleinheiten pro Elementarzelle.[1]
In den Anionen des Borax liegen Tetraborat-Ionen vor, bei denen jedes Boratom mit zwei oder drei (bei zwei Atomen) weiteren Boratomen über eine Sauerstoffbrücke miteinander verbunden ist. Zusätzlich ist jedes Boratom durch eine Hydroxygruppe nach außen abgesättigt, so dass sich eine Formel von [B4O5(OH)4]2− für das Anion ergibt.[6]
Verwendung
Als Rohstoff
Borax wird heute nahezu ausschließlich aus dem kristallwasserärmeren Boraxmineral Kernit gewonnen und ist ein wichtiger Rohstoff zur Herstellung von Borsäure, zur Gewinnung von Boraten und Perboraten sowie weiterer Bor-Verbindungen. Borax wird für Glasuren auf Steingut, Keramik, Porzellan, Glas und bei der Emailproduktion verwendet.
Seine Verwendung als Flussmittel beim Hartlöten von Edelmetallen, sowie beim Feuerschweißen und Schmieden beruht auf seiner oxidablösenden Wirkung (Antioxidationsmittel).[7]
Borax ist neben Polyvinylalkohol, destilliertem Wasser und Lebensmittelfarbe eine Grundsubstanz zur Herstellung des Spielzeugs Slime (Schleim).[8]
In der Chemie
In der Schmelze von Borax lösen sich zahlreiche Metalloxide unter Bildung charakteristischer Färbungen und bilden nach dem Abkühlen eine glasartige Perle, die Boraxperle. Diese Färbungen werden als Nachweis für Kationen beim Kationentrennungsgang eingesetzt.
Die bei der Verbrennung von Methanol mit Borax auftretende grüne Flammenfärbung, die durch Borsäuretrimethylester hervorgerufen wird, ist ein einfacher Nachweis für Methanol. In der Industrie wird es zudem als Vergällungsmittel eingesetzt.
Daneben wird Borax für Pufferlösungen (Borat- sowie Borat-Phosphat-Puffer) und in der Borax-Karmin-Lösung (Grenachers-Lösung) als Farbstoff in der Mikroskopie verwendet.
Im Haushalt
Im Haushalt findet Borax Anwendung in Seife, in Wasserenthärtern, und als Perborat in Waschmitteln.[9] Borax wird in Desinfektions-, Putz- und Bleichmitteln sowie in Insektiziden (bei Ameisenfallen) eingesetzt.
Des Weiteren wirkt Borax als vorbeugendes Holzschutzmittel gegen Schimmel und Insekten[7] und wird zu etwa 10 bis 20 Gewichtsprozent der Gesamtmenge als Flammschutzmittel, hier vorwiegend für Dämmstoffe auf Zellulosebasis, eingesetzt.[10][11] In letztgenannter Anwendung werden seine Eigenschaften als teilweise problematisch angesehen und eine Minderung als sinnvoll erachtet.[12]
Als Lebensmittelzusatzstoff hat es die Bezeichnung E 285.
Vorsichtsmaßnahmen
Borax kann bei Haut- oder Augenkontakt sowie beim Einatmen des feinen Pulvers Entzündungen hervorrufen. Bei Verschlucken kann es zu Reizungen des Magen-Darm-Trakts kommen. Die letale Dosis (LD50-Wert) wird beim Erwachsenen mit 2 bis >6 Gramm je Kilogramm Körpergewicht angegeben[12]. Wegen seiner Einstufung als ein fortpflanzungsgefährdender Stoff wird es mit dem Gefahrensysmbol T - Giftig - gekennzeichnet. (R- und S-Sätze: R: 60-61, S: 53-45) [4].
Die CAS-Nummer des wasserfreien Natriumtetraborat ist 1330-43-4[13], die des Pentahydrats 12179-04-3[14] und die von Borax (Natriumtetraborat-Decahydrat) 1303-96-4[15].
Siehe auch
Literatur
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. Nebel Verlag GmbH, Eggolsheim 2002, ISBN 3-89555-076-0, S. 133.
Weblinks
 Commons: Borax – Sammlung von Bildern, Videos und Audiodateien
Commons: Borax – Sammlung von Bildern, Videos und Audiodateien- Mineralienatlas:Borax (Wiki)
- Die Verbraucher-Initiative über Borax
- Bundesinstitut für Risikobewertung – Borax (PDF, 147 kB)
- Datenblatt Borax bei Merck, abgerufen am 19. Januar 2011.
Einzelnachweise
- ↑ a b c Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 346.
- ↑ a b c d Webmineral – Borax (engl.)
- ↑ a b c d MinDat – Borax (englisch)
- ↑ a b c Eintrag zu Natriumtetraborat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. September 2007 (JavaScript erforderlich).
- ↑ John Randolph Spears: Illustrated Sketches of Death Valley and Other Borax Deserts of the Pacific Coast, Seite 172. ISBN 978-0-554-70751-8, abgefragt am 7. Januar 2009.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1108.
- ↑ a b Kremer-Pigmente – Borax.
- ↑ Uni Bayreuth – Effektexperimente: Slime.
- ↑ Eintrag in der Household Products Database der NLM
- ↑ www.waermedaemmstoffe.com: Vergleich der wichtigsten Dämmstoffe, abgerufen am 23. Februar 2010.
- ↑ Schadstoffberatung Tübingen: Welche Vor- und Nachteile haben verschiedene Dämmmaterialien?, abgerufen am 23. Februar 2010.
- ↑ a b Leisewitz et al. Forschungsbericht Nr. 297 44 542 im Auftrag des Umweltbundesamtes (Dez. 2000), S. 121 ff.
- ↑ ChemCAS - Sodium tetraborate, anhydrous
- ↑ ChemCAS - Sodium borate, pentahydrate
- ↑ ChemCAS - Sodium borate, decahydrate
Kategorien:- Stoff mit reproduktionstoxischer Wirkung
- Mineral
- Bormineral
- Natriummineral
- Monoklines Kristallsystem
- Borate
- Biozid (Wirkstoff)
- Insektizid
- Lebensmittelkonservierungsstoff
Wikimedia Foundation.