- Borsäuretitration
-
Strukturformel 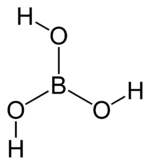
Allgemeines Name Borsäure Andere Namen Borofax
Summenformel H3BO3 CAS-Nummer 10043-35-3 ATC-Code S02AA03
Kurzbeschreibung weißes Pulver[1] Eigenschaften Molare Masse 61,83 g·mol−1 Aggregatzustand fest[1]
Dichte 1,44 g/cm3[2]
Schmelzpunkt Zersetzung bei 185 °C[1]
Dampfdruck 2,7 hPa[1] (20 °C)
Löslichkeit 50 g/l in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Giftig (T) R- und S-Sätze R: 60-61 S: 45-53 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 2660 mg/kg[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Borsäure (auch: Orthoborsäure), H3BO3, ist die einfachste Sauerstoffsäure des Bors. Ihre Salze heißen Borate.
Inhaltsverzeichnis
Eigenschaften
Reine Borsäure bildet schuppige, farblos-glänzende Kristalle, die einen Schmelzpunkt von 171 °C haben. Diese bilden eine Schichtstruktur aus, bei der zwischen den einzelnen Borsäuremolkülen Wasserstoffbrückenbindungen ausgebildet werden. Der Abstand zweier Schichten beträgt 318 pm.
Sie löst sich anfangs nur schwer in Wasser, aber mit steigender Konzentration beschleunigt sich dieser Vorgang. Die Lösung reagiert schwach sauer. Beim Erhitzen der Orthoborsäure spaltet sich Wasser ab, und es entsteht die in mehreren Modifikationen auftretende Metaborsäure HBO2 und schließlich unter weiterer Wasserabspaltung Dibortrioxid (B2O3).
Trotz ihrer drei Wasserstoffatome reagiert Borsäure in Wasser wie eine einprotonige Säure und reagiert zum Tetrahydroxoborat-Ion, B(OH)4-. Hierbei verhält sie sich nicht wie eine Brønsted-Säure als Protonendonator, sondern wie eine Lewis-Säure als Hydroxidakzeptor:
Borsäure ist eine sehr schwache Säure (pKs = 9,25). Durch Umsetzung mit mehrwertigen Alkoholen wie zum Beispiel Mannitol kann die Säurestärke erheblich gesteigert werden. Dies ist bedingt durch eine Verschiebung des Gleichgewichtes auf die rechte Seite hin zu einem Tetraoxoborat-Derivat in Folge einer Veresterung:
Diese Umsetzung wird zur alkalimetrischen Titration von Borsäure verwendet.
Vorkommen und Gewinnung
Freie Borsäure findet sich in den Wasserdampfquellen (Fumarolen) Mittelitaliens in der Toskana, aus diesen Quellen lässt sich die Säure durch Eindampfen in glänzenden Plättchen gewinnen. Ebenfalls in der Toskana kommt die Borsäure als Mineral Sassolin vor. Große Bedeutung haben aber Alkali- und Erdalkalisalze, wie beispielsweise das Mineral Kernit Na2B4O7 · 4 H2O. Ein ähnliches, selteneres Mineral ist Borax, dieses enthält 8 bzw. 10 Äquivalente Kristallwasser. Dieses wird heutzutage aber überwiegend aus Kernit gewonnen. Durch Behandeln von Borax mit Salzsäure oder Schwefelsäure lässt sich Borsäure freisetzen.
Nachweis
Borsäure und ihre Salze, die Borate, bilden mit Methanol den flüchtigen Borsäuremethylester, der mit grüner Flamme brennt und zum qualitativen Bornachweis dient. Bei Ethanol und höheren Alkoholen ist zur Veresterung ein Zusatz von konzentrierter Schwefelsäure erforderlich.
Verwendung
Die wässrige Lösung („Borwasser“) dient als mildes Desinfektionsmittel und ist auch als Konservierungsmittel E 284 zugelassen. Borsäure ist ein Zwischenprodukt zur Herstellung von Borosilikatglas, Porzellan, Emaille und kommt auch in Flammschutzmitteln und Beizen vor. Die Weltjahresproduktion von Borsäure beträgt über 200 Kilotonnen.
Eine weitere Anwendung der Borsäure ist der Einsatz in Kernkraftwerken mit Druckwasserreaktoren. Dort wird die Borsäure wegen des hohen Absorptionskoeffizienten für thermische Neutronen des in natürlichem Bor zu 20 Prozent vorhandenen Isotops B-10 verwendet, um den Multiplikationsfaktor k und damit die Leistung des Reaktors zu steuern. Hierbei kommt es dann zu folgender Zerfallsreihe:
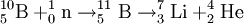
Weiterhin wird die Borsäure zur Berechnung des Kohlenstoffdioxid-Gehaltes in erdgeschichtlichen Zeiten benutzt. In saurem Milieu wird verstärkt 11Bor in Borsäure eingebaut. Wenn sich der pH-Wert ins alkalische verändert, wandelt sich die Borsäure in Borat, das Salz der Borsäure, um. Da Foraminiferen (fossile als auch rezente Einzeller), Borat für den Aufbau ihrer Schale benötigen, kann anhand des Verhältnisses festgestellt werden, welcher pH-Wert zu welchem Zeitpunkt der Erdgeschichte in diesem Gebiet vorlag. Da die Schalen solcher Einzeller als auch Muscheln etc. den Hauptteil des marinen Sediments stellen, können von dort einfach Sedimentkerne entnommen und im Labor auf die beiden Bor-Isotope untersucht werden. Solche Ergebnisse korrelierten hervorragend mit den aus in Eiskernen eingeschlossenen Luftblasen.
Borsäure in Verbindung mit Methanol ruft eine grüne Flammenfärbung hervor; in Verbindung mit anderen Alkoholen einen grünen Flammensaum. Diese Eigenschaft wird in der Pyrotechnik genutzt, um beispielsweise Flammenstäbe, Pois oder Feuerschalen zu färben.
3%ige Borsäurelösung (Borwasser) kann bei Verätzungen durch Laugen verwendet werden. Sie wirkt selbst nicht ätzend und kann andere Laugen neutralisieren.
In als Spielzeug verkauftem Schleim („Slimys“) wurden bis zu 1,3 % Borsäure nachgewiesen.[4] Mit dem Borsäuregehalt steigt die Viskosität der schleimigen Masse. Bei Herstellung ist auf konstant niedrigen Gehalt zu achten, da bereits bei Aufnahme von nur 50 mg/kg Körpergewicht mit einer gesundheitlichen Beeinträchtigung gerechnet werden muss.[5]
Quellen
- ↑ a b c d e f Sicherheitsdatenblatt (Merck)
- ↑ Eintrag zu CAS-Nr. 10043-35-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 10.11.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 10043-35-3 im European chemical Substances Information System ESIS
- ↑ Stellungnahme des BfR (früher BgVV) vom 03.03.1995 http://www.bfr.bund.de/cm/216/borsaeuregehalte_in_slimys_zu_hoch.pdf. Stand 08. Oktober 2008.
- ↑ Stellungnahme des BfR (früher BgVV) vom 03.03.1995 http://www.bfr.bund.de/cm/216/borsaeure_in_huepfknete.pdf. Stand 08. Oktober 2008.
Wikimedia Foundation.

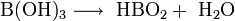
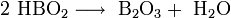
![\mathrm{B(OH)_3 + H_2O \rightleftharpoons [B(OH)_4]^- + H^+}](/pictures/dewiki/48/094aa7901b793db4359e1a9103aab076.png)
