- β-Carotin-15,15′-Monooxygenase
-
Β-Carotin-15,15′-Monooxygenase —
Masse/Länge Primärstruktur 547 Aminosäuren Kofaktor Eisen Bezeichner Gen-Name BCMO1 Externe IDs OMIM: 605748 UniProt: Q9HAY6 Enzymklassifikation EC, Kategorie 1.14.99.36 Monooxygenase Reaktionsart Oxidierende Spaltung Substrat β-Carotin + O2 Produkte Retinal Vorkommen Homologie-Familie Carotinoid-Oxygenase Übergeordnetes Taxon Bakterien, Tiere Beta-Carotin–15,15′-Monooxygenase (BCO) ist das Enzym, das β-Carotin in zwei Moleküle Retinal zerlegt und so als Vitamin A aktiviert. Dieser Vorgang findet beim Menschen vor allem im Darm, aber auch in Epithelzellen der Netzhaut, Leber und Nieren statt. Seltene Mutationen im menschlichen BCMO-Gen können zu erblicher Hypercarotinämie mit Vitamin-A-Mangel führen.
BCO gehört zu den Carotinoid-Oxygenasen und hat sich mit den mehrzelligen Tieren entwickelt. Homologe Proteine sind in einigen wenigen Bakterienarten vorhanden.[1]
Katalysierte Reaktion
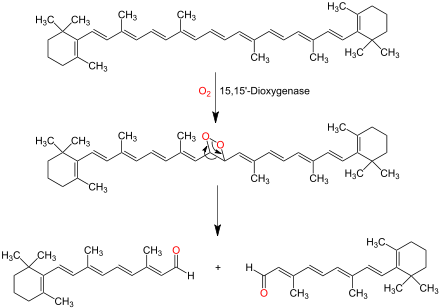 Oxidativer Abbau von β-Carotin (oben) unter Einwirkung von 15,15′-Dioxygenase führt über ein Dioxetan (Mitte) zu zwei Equivalenten all-trans-Retinal (unten).[2]
Oxidativer Abbau von β-Carotin (oben) unter Einwirkung von 15,15′-Dioxygenase führt über ein Dioxetan (Mitte) zu zwei Equivalenten all-trans-Retinal (unten).[2]
Einzelnachweise
- ↑ UniProt Q9HAY6
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 147−148, ISBN 978-3-906390-29-1.
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Carotenoid Oxygenase. (engl.)
Wikimedia Foundation.
