- Caprolacton
-
Strukturformel 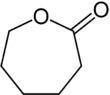
Allgemeines Name ε-Caprolacton Andere Namen - ε-Lacton
- 6-Hydroxyhexansäurelacton
- 6-Hydroxycapronsäurelacton
- 6-Caprolacton
- Hexanolacton
- 6-Hexanolid
- 2-Oxepanon
- Hexansäure-epsilon-lacton
- Caprolacton
Summenformel C6H10O2 CAS-Nummer 502-44-3 PubChem 10401 Kurzbeschreibung farblose Flüssigkeit[1] Eigenschaften Molare Masse 114,14 g·mol−1 Aggregatzustand flüssig
Dichte 1,08 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 235 °C[1]
Dampfdruck Löslichkeit mischbar mit Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 41 S: 26 LD50 5990 mg/kg (Kaninchen, dermal)[2]
WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. ε-Caprolacton, auch ε-Lacton oder Caprolacton ist eine chemische Verbindung aus der Stoffgruppe der Lactone. Sie besteht aus einem siebengliedrigen Ring.
Inhaltsverzeichnis
Darstellung
Es sind eine ganze Reihe von Möglichkeiten zur Synthese von Caprolacton bekannt, die sich in zwei Gruppen aufteilen lassen. Zum Einen ist die Herstellung ausgehend von offenkettigen Verbindungen, meist Derivaten des Hexans möglich, zum Anderen die Ringerweiterung von Ketonen.
Ausgehend von offenkettigen Verbindungen können beispielsweise 6-Hydroxyhexansäure[3], 1,6-Hexandiol[4] oder Adipinsäure[5] dienen.
Ausgehend von cyclischen Verbindungen kann Caprolacton durch eine Baeyer-Villiger-Oxidation von Cyclohexanon mit Persäuren, wie Peressigsäure[6], Perbenzoesäure[7] oder m-Chlorperbenzoesäure[8] hergestellt werden. Die Oxidation kann jedoch auch mittels Katalysatoren durch Sauerstoff bewerkstelligt werden.[9][10]
Eigenschaften
Caprolacton ist eine farblose Flüssigkeit, die bei −1,5 °C erstarrt und bei 235 °C siedet. Ihr Brechungsindex beträgt bei einer Temperatur von 20 °C und einer Wellenlänge von 589 nm 1,463.[11] Sie besitzt bei 20 °C eine dynamische Viskosität von 6,67 mPa‣s.[2] Ihr Flammpunkt beträgt 127 °C, ihre Zündtemperatur 204 °C.[2] Im Bereich von 1,2–9 Volumenprozent bildet sie mit Luft explosible Gemische.[2] Bei Temperaturen über 220 °C beginnt sie sich zu zersetzen.[2]
Verwendung
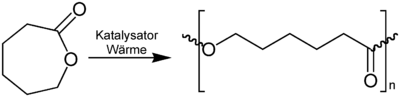
Caprolacton dient als Grundstoff zur Herstellung von Polycaprolacton[3], einem Kunststoff aus der Gruppe der Thermoplasten.
Herstellung von Polyestern aus ε-Caprolacton
Caprolacton kann leicht durch Lewis-Säure- oder Brønstedt-Säuren geöffnet werden, was die Herstellung von Hexanderivaten ermöglicht.Quellen
- ↑ a b c d e f g h Eintrag zu γ-Butyrolactam in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14.08.2008 (JavaScript erforderlich)
- ↑ a b c d e Sicherheitsdatenblatt Merck
- ↑ a b F. J. van Natta, J. W. Hill, W. H. Carothers: Studies of Polymerization and Ring Formation. ε-Caprolactone and its Polymers, in: J. Am. Chem. Soc. 1934, 56, 455
- ↑ W. Reppe: Äthinylierung VI, in: Liebigs Ann. 1955, 596, 1, 158–224.
- ↑ U. Matteoli, G. Menchi, M. Bianchi, P. Frediani, F. Piacenti: Gazzetta Chimica Italiana 1985, 115, 603–606
- ↑ P. S. Starcher, B. Phillips: Synthesis of Lactones, in: J. Am. Chem. Soc. 1958, 80, 4079–4082.
- ↑ S. L. Friess: Reactions of Per Acids. II. The Reaction of Perbenzoic Acid with Simple Cyclic Ketones. Kinetic Studies, in: J. Am. Chem. Soc. 1949, 71, 2571,2572.
- ↑ S. Horvat, P. Karallas, J. M. White: Reactions of β-trimethylstannylcyclohexanones with peracids: investigations into the stannyl-directed Baeyer–Villiger reaction, in: J. Chem. Soc. Perkin Trans. 2 1998, 10, 2151–2154.
- ↑ C. Bolm, G. Schlingloff, K. Weickhardt: Use of molecular oxygen in the Baeyer-Villiger oxidation the influence of metal catalysts, in: Tetrahedron Letters 1993, 34, 3405–3408.
- ↑ S.-I. Murahashi, Y. Oda, T. Naota: Fe2O3-catalyzed baeyer-villiger oxidation of ketones with molecular oxygen in the presence of aldehydes, in: Tetrahedron Letters 1992, 33, 7557–7560
- ↑ Sicherheitsdatenblatt Fluka
Wikimedia Foundation.