- Chaperonine
-
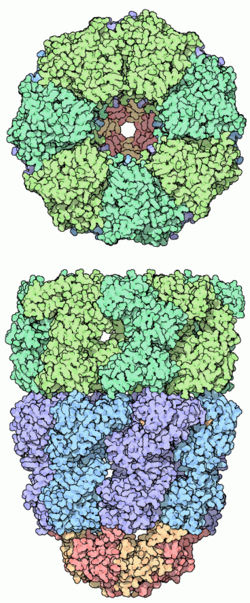
Chaperonin Klasse I aus Escherichia coli, bestehend aus zwei Ringen (blau, grün) aus 7x2 GroEL-Einheiten und einem Deckel aus GroES-Proteinen (rot, gelb). Oben: Draufsicht. Unten: Seitenansicht. Die Höhlung bietet den Proteinen Schutz bei der Faltung
Die Klasse der 60-kDa Hitzeschockproteine, auch Chaperonine genannt, sind eine der wichtigsten Komponenten des Chaperonsystems in biologischen Zellen.
Klassifizierung
Hsp60-Proteine werden in zwei Klassen eingeteilt:
- Klasse 1 besteht aus Hsp60 in Mitochondrien und GroEL in Bakterien, Proteine, die 7-gliedrige ringförmige "Fässer" bilden, deren "Deckel" und "Boden" aus je 7 Molekülen Hsp10 bzw. GroES bestehen.
- Klasse 2 besteht aus dem zytosolischen Chaperonin CCT (auch c-cpn oder TRiC) in höheren Eukaryoten und dem Thermosom in Archaebakterien. Diese Proteine bilden 8- bis 9-gliedrige Ringe. Hier werden "Deckel" und "Boden" der "Fässer" durch Auswüchse der Tertiärstruktur der Proteine selbst gebildet.
Funktion
Chaperonine helfen neusynthetisierten Bakterienproteinen bei der Faltung ihrer physiologischen Sekundärstruktur.
- GroEL wird bei der Synthese von schätzungsweise einem Drittel aller mittelgroßen (30–60 kDa) Bakterienproteine benötigt. Ungefaltete Aminosäureketten binden hierbei unspezifisch an GroEL (das heißt viele verschiedene Proteine können als Substrat an GroEL binden), werden eingeschlossen, und können im Inneren des Chaperoninkomplexes ihre physiologische Struktur annehmen. Nach einem Zyklus von ATP-Hydrolyse an den 7 GroEL-Untereinheiten wird das gefaltete Substratprotein freigesetzt.
- CCT hat ein weitaus begrenzteres Substratspektrum. Hier binden ungefaltete Proteine spezifisch an jeweils eine oder mehrere der CCT-Untereinheiten. Zu den Proteinen, die CCT als Faltungshelfer brauchen, zählen die Zytoskelett-Proteine Aktin und Tubulin, einige aktinähnliche Proteine, und offenbar nur wenige andere.
Siehe auch
Wikimedia Foundation.