- Proteinfaltung
-
Übergeordnet Metabolismus der Proteine Untergeordnet de novo-Proteinfaltung
Proteinfaltung mit ChaperonenGene Ontology AmiGO QuickGO Die Proteinfaltung ist der Prozess, durch den Proteine ihre dreidimensionale Struktur erhalten. Die Proteinfaltung findet während und nach der Synthese der Peptidkette statt, und ist Voraussetzung für die fehlerfreie Funktion des Proteins. Die Faltung findet nicht von alleine statt: verantwortlich sind kleinste Bewegungen der Lösungsmittelmoleküle (Wasser), die an das Protein stoßen, sowie elektrische Anziehungskräfte innerhalb des Proteinmoleküls. Weiterhin können manche Proteine nur mithilfe von bestimmten Enzymen oder Chaperon-Proteinen die richtige Faltung erreichen. Fehlgefaltete Proteine werden normalerweise im Rahmen der Proteinqualitätskontrolle erkannt und im Proteasom abgebaut. Werden sie nicht abgebaut, so können diese Proteinansammlungen verschiedene – vom Typ des Proteins abhängige – Erkrankungen, wie beispielsweise Alzheimer, Parkinson oder Chorea Huntington auslösen; die Proteinfehlfaltungserkrankungen.
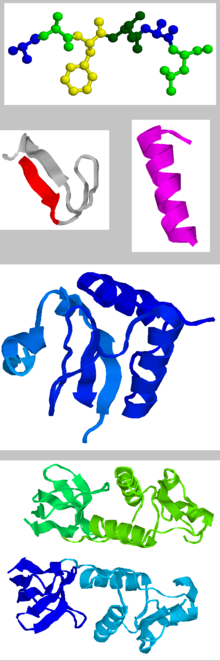 Bei der Proteinfaltung faltet sich die Kette der Aminosäuren (oben) zu Sekundär- (rot, violett) und Tertiärstruktur (blau).
Bei der Proteinfaltung faltet sich die Kette der Aminosäuren (oben) zu Sekundär- (rot, violett) und Tertiärstruktur (blau).
Inhaltsverzeichnis
Proteinsynthese
Proteine werden an Ribosomen als lineare Polymere aus Aminosäuren synthetisiert. Die Abfolge der einzelnen Aminosäuren ist die Primärstruktur. Während oder nach der Synthese falten sich diese Aminosäure-Ketten in eine definierte räumliche Struktur (Tertiärstruktur), die kleinere Strukturelemente (Sekundärstruktur) enthält. Bilden sich außerdem noch Oligomere aus mehreren Proteinen in Tertiärstruktur, so spricht man von einer Quartärstruktur.
Während der Faltung nimmt die Kette von Aminosäuren innerhalb von Sekundenbruchteilen die einzig richtige aus einer sehr großen Anzahl möglicher Konformationen an (→ das Levinthal-Paradox). Der genaue Ablauf der Proteinfaltung ist noch nicht geklärt, aber es steht fest, dass das gefaltete Protein in der Regel die niedrigste Gibbs-Energie aller möglichen Zustände hat. Außerdem scheint der Weg dorthin über lokale Energieminima zu verlaufen. Unterstützt und für viele Proteine erst ermöglicht wird der Prozess durch Faltungshelfer (zum Beispiel Chaperone).
Bei einigen Proteinen verläuft die Faltung auch über einen Zwischenzustand, der molten globule genannt wird. Dabei werden aufgrund des hydrophoben Kollaps (die hydrophoben Aminosäurereste lagern sich zusammen) innerhalb von einigen Millisekunden alle Sekundärstrukturen ausgebildet. Die Tertiärstruktur wird erst danach ausgebildet, was einige Sekunden in Anspruch nehmen kann.
Anfinsens Dogma besagt, dass die native Struktur jedes Proteins durch die Sequenz der Aminosäuren festgelegt ist. Eine Ausnahme bilden seltene metamorphische Proteine wie Lymphotactin, die zwei grundsätzlich verschiedene Sekundärstrukturen haben. [1]
Struktur und Funktion
Siehe den Hauptartikel: Proteinstruktur
Die Funktion der Proteine als Enzyme, Strukturbausteine (beispielsweise Keratin der Haare) etc. ist nur durch eine definierte Struktur möglich. Dadurch ist die Proteinfaltung von großer Bedeutung für die Biologie und Medizin. Durch falsche Faltung von Proteinen hervorgerufene Krankheiten fallen in mehrere Sparten:
- solche, bei denen Mutationen die korrekte Faltung verhindern und damit das Protein nicht mehr funktioniert. Beispiel: Formen von Krebs, die auf Mutationen im Protein p53 zurückgehen.
- solche, bei denen Mutationen die korrekte Faltung verhindern und damit das Protein aggregiert. Beispiel: Sichelzellenanämie, bei der Hämoglobin aggregiert; die Alzheimer-Krankheit; die Parkinson-Krankheit; die Chorea Huntington.
- solche, bei denen Mutationen die korrekte Faltung verhindern und damit das Protein toxisch wirkt. Beispiel: BSE, verursacht durch die Prionen.
Denaturierung
Bei der Faltung nimmt das Protein den nativen (strukturierten oder biologisch funktionsfähigen) Zustand an. Den umgekehrten Prozess nennt man Denaturierung. Faltung und Denaturierung von Proteinen ähneln Phasenübergängen erster Ordnung, das heißt extensive Größen wie Volumen und Wärmeenergie ändern sich sprunghaft. Proteindenaturierung wird durch Hitze, extreme pH-Bedingungen, extreme Salzkonzentrationen, Lösungsmittel und anderes ausgelöst.
Forschung
Die erste umfassende Theorie zur Proteinfaltung wurde in den 1920er Jahren von dem chinesischen Wissenschaftler Hsien Wu entwickelt. Im europäisch/amerikanischen Raum wurden die ersten wesentlichen Arbeiten von Christian B. Anfinsen (Nobelpreis für Chemie 1972) in den 1950er Jahren durchgeführt.
Zur Zeit läuft das Projekt „Folding@home“ der Stanford-Universität zur Simulation dieser Faltungen, bei dem Internetnutzer mithelfen können, indem sie Rechenleistung zur Verfügung stellen. Auch die Projekte „POEM@home“ der Universität Karlsruhe und „Rosetta@home“ der University of Washington verfolgen dieses Ziel, allerdings verwenden alle drei Projekte unterschiedliche Ansätze zur Simulation der Proteinfaltung. Einen weiteren Ansatz verfolgt das Computerspiel Foldit, bei dem die Spieler versuchen, das Protein möglichst geschickt zu falten und es so auf ein tiefes Energieniveau zu bringen.
Des Weiteren findet alle zwei Jahre das Gemeinschaftsexperiment CASP statt, welches Forschergruppen die Möglichkeit bietet, die Qualität ihrer Methoden zur Vorhersage von Proteinstrukturen ausgehend von der Primärstruktur zu testen und sich einen Überblick über den aktuellen Stand auf diesem Forschungsgebiet zu verschaffen.
Einzelnachweise
- ↑ R. L. Tuinstra, F. C. Peterson, S. Kutlesa, E. S. Elgin, M. A. Kron, B. F. Volkman: Interconversion between two unrelated protein folds in the lymphotactin native state. In: Proceedings of the National Academy of Sciences of the United States of America. Band 105, Nummer 13, April 2008, S. 5057–5062, ISSN 1091-6490. doi:10.1073/pnas.0709518105. PMID 18364395. PMC 2278211.
Weblinks
Wikimedia Foundation.
