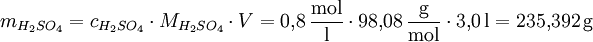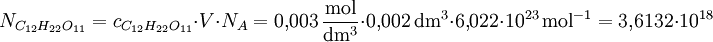- Chemische Konzentration
-
Unter der Stoffmengenkonzentration (Formelzeichen: c) oder Molarität (veralteter Begriff) versteht man den Quotienten aus der Stoffmenge (n) eines gelösten Stoffes X und dem Volumen (V) der Lösung. Bei Kenntnis der molaren Masse kann aus der Stoffmengenkonzentration die Massenkonzentration, mit Hilfe der Avogadro-Konstante kann aus der Stoffmengenkonzentration die Teilchenzahlkonzentration berechnet werden.
Inhaltsverzeichnis
Geschichtliches
Früher wurde das Symbol „M“ für die Maßeinheit mol/L verwendet und auch zusammen mit SI-Vorsätzen benutzt; diese Schreibweise ist jedoch nicht mit dem Internationalen Einheitensystem (SI) verträglich. Nach IUPAC-Empfehlung soll nur die Stoffmengenkonzentration im Englischen mit „concentration“ bezeichnet werden.[1]
Schreibweise
Die Stoffmengenkonzentration kann in der Einheit Mol pro Liter angegeben werden:
Mit einer 2,5-molaren (veraltete Darstellungsweise auch: 2,5 M) wässrigen Schwefelsäure ist eine solche gemeint, die 2,5 Mol Schwefelsäure-Moleküle in 1 Liter Lösung einer bestimmten Temperatur enthält; hierbei ist die übliche Einheit mol/l zugrunde gelegt;
Rechenbeispiele
In einer 0,8-molaren (0,8 M) Schwefelsäurelösung (molare Masse von Schwefelsäure: 98,08 g/mol) sind pro Liter Lösung 0,8 mol H2SO4 enthalten. Die entsprechende Masse an H2SO4 für ein Volumen V = 3 Liter einer solchen Schwefelsäure beträgt:
Die Teilchenzahl N einer 3-millimolaren (3 mM) Lösung von Rohrzucker in Wasser bei einem Lösungsvolumen V = 2 Kubikzentimeter, wobei NA (Avogadro-Konstante) die Anzahl der Teilchen pro Mol angibt, beträgt:
Siehe auch
- Äquivalentkonzentration
- Gehaltsangaben, Massenkonzentration, Volumenkonzentration
- Molalität
- Stoffmengenanteil
- Osmolarität
- Osmolalität
- Stöchiometrie
Einzelnachweis
Wikimedia Foundation.

![c_X = \frac {n_X}{V} \qquad [c_X] = 1 \frac{\rm mol}{\rm l}](/pictures/dewiki/55/75881faf16568e7e96f6da8f5cd98e23.png)