- Pollenallergen Bet V 1
-
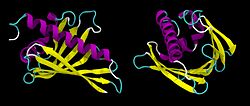
Pollenallergen Bet v 1-A (Hänge-Birke, Betula verrucosa) Bändermodell des Monomers von zwei Seiten, nach PDB 1QMR Vorhandene Strukturdaten: 1BV1, 1FSK, 1LLT, 1QMR Masse/Länge Primärstruktur 159 Aminosäuren Sekundär- bis Quartärstruktur Homodimer Bezeichner Gen-Name(n) BETVIA; PR-10 Externe IDs UniProt: P15494 Vorkommen Übergeordnetes Taxon Gefäßpflanzen[1] Bet v 1 heißen mehrere Proteine der Hänge-Birke (Betula pendula) mit zum Teil starker Allergenität für den Menschen - Bet v 1-A ist die Hauptursache für Birkenallergie. Die Proteine gehören zu den PR-10-Proteinen, die von vielen Gefäßpflanzen als Antwort oder im Hinblick auf mikrobielle Pathogene in verschiedenen Gewebetypen erzeugt werden. Die Zusammensetzung der PR-10-Proteine im Pollen ist je nach Baum unterschiedlich und daher auch die Stärke der Gesamtallergenität dieser Pollen individuell für jede Birke.[2][3]
Eine Unterfamilie der PR-10-Proteine fasst alle zu Bet v 1 homologen Proteine zur BetVI-Familie zusammen; auch Mitglieder dieser Familie sind breit verstreut im Pflanzenreich und viele sind starke Allergene. Da es sich bei allen Mitgliedern aufgrund der Homologie um das gleiche Epitop handelt, ist hier der Grund für Kreuzallergien zu suchen. Weitere Mitglieder der BetVI-Familie sind beispielsweise:[1]
- Api G I von Apium graveolens (Sellerie)
- Cor a I von Corylus avellana (Haselnuss)
- Mal d I von Malus domestica (Kulturapfel)
- Ara h 8 von Arachis hypogaea (Erdnuss)
Ein Hinweis auf die genaue Funktion ist eine Bindedomäne der Proteine, die bevorzugt Lipide wie Cholesterin und Lecithin binden kann. In der Zellkultur wurde ausschließlich bei Allergikern ein Eindringen des Proteins in Epithelzellen über die Lipid Rafts der Zellmembran beobachtet, während das Immunsystem der gesunden Personen diesen Vorgang verhindert.[4][5][6]
Einzelnachweise
- ↑ a b IPR000916 Bet v I allergen. In: InterPro 28.0. EBI, abgerufen am 6. Oktober 2010 (englisch).
- ↑ Schenk MF, Cordewener JH, America AH, Van't Westende WP, Smulders MJ, Gilissen LJ: Characterization of PR-10 genes from eight Betula species and detection of Bet v 1 isoforms in birch pollen. In: BMC Plant Biol.. 9, 2009, S. 24. doi:10.1186/1471-2229-9-24. PMID 19257882. Volltext bei PMC: 2671506.
- ↑ UniProt P15494
- ↑ Mattila K, Renkonen R: Modelling of Bet v 1 binding to lipids. In: Scand. J. Immunol.. 70, Nr. 2, August 2009, S. 116–24. doi:10.1111/j.1365-3083.2009.02277.x. PMID 19630917.
- ↑ Renkonen J, Mattila P, Lehti S, et al.: Birch pollen allergen Bet v 1 binds to and is transported through conjunctival epithelium in allergic patients. In: Allergy. 64, Nr. 6, Juni 2009, S. 868–75. doi:10.1111/j.1398-9995.2008.01919.x. PMID 19154545.
- ↑ Mattila P, Renkonen J, Toppila-Salmi S, et al.: Time-series nasal epithelial transcriptomics during natural pollen exposure in healthy subjects and allergic patients. In: Allergy. 65, Nr. 2, Februar 2010, S. 175–83. doi:10.1111/j.1398-9995.2009.02181.x. PMID 19804444.
Wikimedia Foundation.