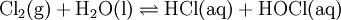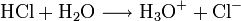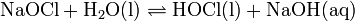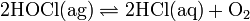- Chlorwasser
-
Chlorwasser nennt man die Lösung von Chlorgas in Wasser.
Herstellung und Chemie
In Wasser ist Chlor gut löslich. In einem Liter Wasser löst sich 0,0921 mol Chlor (25°C,101325 Pa)[1]. Auf Grund der Disproportionierung des Chlors bildet sich neben Chlorwasserstoffsäure auch die Hypochlorige Säure. Der größte Teil des Chlors bleibt jedoch als Cl2 physikalisch gelöst. Auch nach langem Lagern disproportioniert Chlorwasser nie vollständig, da die entstehende Hypochlorige Säure die ebenfalls gebildete Chlorwasserstoffsäure wieder zu Chlorgas und Wasser oxidiert (chemisches Gleichgewicht).
Chlorwasser ist wegen der gebildeten Oxoniumionen eine saure Lösung
und wirkt aufgrund der in ihr enthaltenen Hypochlorit-Ionen oxidierend.
Die Chlorbleiche, die in einer ganzen Reihe von Haushaltsreinigern („Chlorreiniger“ z. B. Dan Klorix u. a.) enthalten ist, enthält jedoch aus praktikablen Gründen kein Chlorwasser, sondern eine wässrige Lösung von Natriumhypochlorit (NaOCl). Die entfärbende und desinfizierende Wirkung beruht sowohl beim Chlorwasser als auch bei Natriumhypochloritlösung auf der oxidativen Eigenschaft des Hypochlorits (im Chlorwasser als Hypochlorige Säure enthalten).
In wässriger Lösung (nicht in alkalischer Lösung) sind Hypochlorite starke Oxidationsmittel und werden vielfach als Bleichmittel (Papier, Textilien) sowie als Desinfektionsmittel (Haushaltsreiniger, Schwimmbad, vgl. Wasseraufbereitung im Schwimmbad) eingesetzt. Bei dem Gebrauch von Hypochloridhaltigen Reinigern zusammen mit sauren Haushaltsreinigern (Essig-, Zitronensäure) können sich jedoch geringe Mengen von giftigen Chlorgas bilden. Aus diesem Grunde werden zusehmend Haushaltsreiniger auf Basis von Wasserstoffperoxid angeboten.
Hypochlorige Säure zersetzt sich langsam hauptsächlich zu Chlorwasserstoffsäure und Sauerstoff.
Antibakterielle Wirkung
Bei Bakterien und Viren beruht die Wirkung darauf, dass Proteinmoleküle ihre räumliche Struktur verlieren und verklumpen.[2] Chlorwasser ist eines der wenigen zuverlässigen Desinfektionsmittel zur Tötung von Filoviren wie z. B. Ebolavirus, Hanta-Virus oder Lassa-Virus.
Einzelnachweise
- ↑ Hollemann, Wiberg: Lehrbuch der anorganischen Chemie, de Gruyter
- ↑ Wissenschaft-aktuell: Wie Chlorbleiche Bakterien tötet
Wikimedia Foundation.