- Natriumhypochlorit
-
Strukturformel 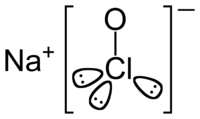
Allgemeines Name Natriumhypochlorit Andere Namen - Unterchlorigsaures Natrium
- Natronbleichlauge
- Chlorbleichlauge
- L'eau de Labarraque
- Eau de Javel
- Javelsche Lauge
Summenformel NaClO CAS-Nummer 7681-52-9 Kurzbeschreibung gelbliche Substanz mit unangenehmem, süßlichem Geruch, die nur in wässriger Lösung haltbar ist [1]
Eigenschaften Molare Masse 74,44 g·mol−1 Aggregatzustand flüssig
Dampfdruck Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 

Gefahr
H- und P-Sätze H: 314-400 EUH: 031 P: 260-301+330+331-303+361+353-305+351+338-405-501 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 31-34-50 S: (1/2)-28-45-50-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumhypochlorit (NaClO) ist das Natriumsalz der hypochlorigen Säure (HClO, veraltet auch „unterchlorige Säure“). Es ist ein weißes Pulver, das im Normalfall sechs Mol Kristallwasser pro Mol Natriumhypochlorit enthält. Der Trivialname der wässrigen Lösung von Natriumhypochlorit ist Eau de Labarraque oder Eau de Javel, wobei die Bezeichnung Eau de Javel strenggenommen nicht korrekt ist, denn dieses bezeichnet eine Lösung von Kaliumhypochlorit, unter Umständen in einer Mischung mit anderen Salzen wie Kaliumchlorid. Im Handel wird jedoch häufig kein Unterschied gemacht.
Inhaltsverzeichnis
Geschichte
Die Bezeichnung Eau de Labarraque geht auf den französischen Apotheker Antoine Germain Labarraque zurück, der ab 1822 in Paris Natrium- und Calciumhypochlorit-Lösungen zu Desinfektionszwecken verkaufte. Die weltweite Verwendung als Antiseptikum setzte sich aber erst im 1. Weltkrieg nach der Wiederentdeckung durch Henry Drysdale Dakin durch (daher der Name Dakin's solution im Englischen).
Gewinnung/Darstellung
Natriumhypochlorit wird durch Einleiten von Chlorgas in Natronlauge oder durch Elektrolyse einer Natriumchlorid-Lösung hergestellt.
Diese Reaktion verursacht erhebliche technische Probleme. Da es sich formal um eine Hydrolyse des Chlors handelt nach
mit nachfolgender Neutralisation der so entstehenden Salzsäure bzw. hypochlorigen Säure, ist leicht erkennbar, dass die Reaktionsenthalpien dieser Reaktionen zu einer starken Erwärmung führen, gegen die alle Hypochlorite empfindlich sind. Tatsächlich wird der gleiche chemische Prozess dazu verwendet, Chlorat herzustellen, jedoch durch Reaktion in heißer Lösung. Aus diesem Grunde enthalten alle technischen Hypochlorite wechselnde, manchmal große Mengen von Chlorat. Auch die Reaktion von bei der Herstellung entstandenem Hypochlorit mit Chlor führt schließlich zu Chlorat.
Verwendung
Der Verwendungszweck ist das Bleichen oder Desinfizieren (beispielsweise in Schwimmbädern). Die Verwendung in Schwimmbädern ist nicht unproblematisch, da die zu dosierenden Mengen ausreichen müssen, um das anwesende Ammoniak (bzw. die Amine) über die Stufe des Monochloramins hinaus zu chlorieren, da erst dann eine ausreichende Desinfektion gewährleistet ist.
Natriumhypochlorit ist auch der wesentliche Wirkbestandteil von desinfizierenden und bleichenden Haushaltsreinigern. Auch diverse Schimmelentferner oder Rohrreiniger enthalten diese Chemikalie. Häufig werden sie als „mit Aktivchlor“ beworben.
Weiterhin findet Natriumhypochlorit Anwendung in der Zahnmedizin. So wird es beispielsweise bei der Wurzelkanalbehandlung bakteriell infizierter Zähne eingesetzt, um diese zu desinfizieren.
Eine Studie[3] des Children's Memorial Hospital in Chicago legt nahe, dass die Anwendung von Vollbädern mit einer stark verdünnten Lösung (0,005 %) bei Patienten mit atopischem Ekzem zu einer deutlichen Verbesserung des Beschwerdebilds führt[4].
Sicherheitshinweise
Beim Umgang mit Natriumhypochlorit ist höchste Vorsicht geboten. Es besteht Explosionsgefahr bei der Reaktion von Natriumhypochlorit mit zahlreichen Stoffen und Stoffgruppen, darunter Reduktionsmitteln, Aminen, Ameisensäure, Methanol, organischen Substanzen und einigen weiteren Stoffen. Außerdem greifen entstehende Dämpfe beim Einatmen die Schleimhäute stark an.
Des Weiteren reagiert Natriumhypochlorit mit Säuren (z. B. Salzsäure, Salpetersäure) und Oxidationsmitteln (z. B. Wasserstoffperoxid, Permanganate) zum Teil sehr heftig unter Hitzeentwicklung und Freisetzung von Chlorgas und/oder nitrosen Gasen.
Schon durch Erwärmung oder Sonnenlicht kann es zum Zerfall von Natriumhypochlorit kommen, bei dem unter anderem Chlor, Chlorwasserstoff, Chlordioxid und Sauerstoff freigesetzt werden. Dies ist auch bei der Lagerung des Stoffes zu berücksichtigen.
Siehe auch
Einzelnachweise
- ↑ a b c Eintrag zu CAS-Nr. 7681-52-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Mai 2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 7681-52-9 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ PDF der Studie in Pediatrics
- ↑ Deutsches Ärzteblatt vom 27. April 2009: Haushaltsbleiche lindert Ekzeme
Kategorien:- Ätzender Stoff
- Umweltgefährlicher Stoff
- Natriumverbindung
- Hypochlorit
Wikimedia Foundation.


