- Zimmerman-Traxler-Modell
-
Das Zimmerman-Traxler-Modell dient zur Erklärung des stereochemischen Verlaufes von organischen Reaktionen.
Definition
Entstehen bei organischen Reaktionen unter Knüpfung einer C-C-Bindung neue Stereozentren, ist die Vorhersage der Stereoselektivität, also die Vorhersage, welches Stereoisomer bevorzugt gebildet wird, von besonderer Bedeutung. Hierzu bedient man sich der Modellvorstellung eines 6-gliedrigen Übergangszustandes, des Zimmermann-Traxler-Übergangszustandes. Die direkt an der Reaktion beteiligten Atome werden hierzu in einem 6-Ring in Sesselkonformation angeordnet und festgehalten. Der größte Substituent befindet sich in äquatorialer Position, was den Zustand energetisch begünstigt. Die übrigen Substituenten werden so angeordnet, dass die sterische Behinderung durch den größten Substituenten möglichst gering ist. Die Bindungen werden dem Reaktionsmechanismus entsprechend gelöst und geformt. Im Allgemeinen wandern die Bindungen innerhalb des 6-Ringes um eine Position. Anschließend wird das gebildete Produkt wieder auf die Lewisschreibweise abgebildet.
Anwendung bei der Aldoladdition
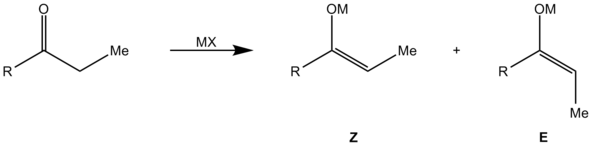
Die Aldoladdition ist ein klassisches Anwendungsbeispiel für das Zimmermann-Traxler-Modell.
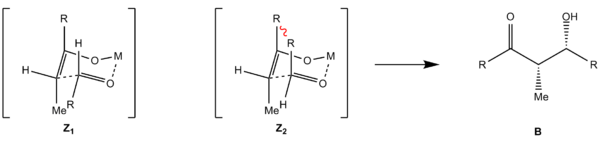
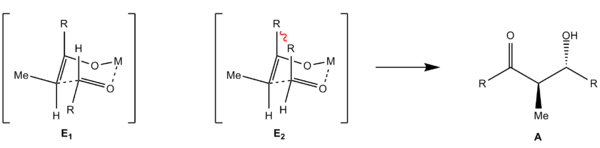
Hierbei reagiert ein Aldehyd mit einem Enolat. Hierbei werden zwei Stereozentren aufgebaut, sodass 4 Stereoisomere entstehen können. Es bildet sich ein sechsgliedriger Übergangszustand aus dem Enolat, der Aldehyd-Carbonylgruppe und dem Kation des Enolats, welches an das Aldehyd-Sauerstoffatom koordiniert. Hierbei kann die Annäherung des Aldehyden an das Enolat auf vier Weisen erfolgen: Die Annäherung des Aldehyden an des Enolat kann von der Vorder- oder Rückseite geschehen. Bei Abwesenheit eines Stereozentrums (Substratkontrolle) erfolgt keine Differenzierung der beiden Halbräume, sodass beide Annäherungen energetisch gleich sind und ein Racemat entsteht.
Des Weiteren kann der Rest R des Aldehyden entweder axial oder äquatorial stehen. Bei axialer Stellung kommt es zu höherer 1,3-diaxialer Spannung, da sich die beiden Reste R von Enolat und Aldehyd räumlich nahe kommen. Damit sind die beiden möglichen Übergangszustände (Z1, Z2 bzw. E1, E2) energetisch unterschiedlich und es kommt bevorzugt zur Reaktion über den günstigeren (äquatoriale Stellung). Es kommt zur Diastereoselektivität, bei der aus dem Z-Enolat bevorzugt das Syn-Aldol (B) und aus dem E-Enolat das Anti-Aldol (A) entsteht.
Literatur
- R. Brückner, "Reaktionsmechanismen", Spektrum Verlag
Wikimedia Foundation.