- Cäsiumchlorid-Gitter
-
Kristallstruktur 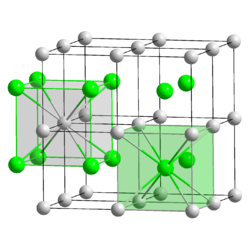
__ Cs+ __ Cl- Kristallsystem kubisch Raumgruppe 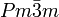
Koordinationszahlen Cs[8], Cl[8] Allgemeines Name Caesiumchlorid Verhältnisformel CsCl CAS-Nummer 7647-17-8 Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 168,36 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 1382 °C[1]
Löslichkeit gut (1860 g/l[1]) in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 2004 mg/kg[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Caesiumchlorid, ein Salz mit der Formel CsCl bildet farblose, kubische Kristalle (Caesiumchloridstruktur) und lässt sich in Wasser, Säuren und Laugen lösen. Die Caesiumkationen und Chloridanionen sind in Lösung frei beweglich, und die Beweglichkeit des Caesiumions in Wasser ist relativ hoch, da das Caesiumion nur eine relativ schwach gebundene Hydrathülle hat. Caesiumchlorid ist hygroskopisch.
Struktur
Caesiumchlorid hat eine charakteristische, kubische Kristallstruktur, bei der jedes Caesiumion von acht Chloridionen und jedes Chloridion von acht Caesiumionen umgeben ist: Die kubische Einheitszelle kann beispielsweise so gewählt werden, dass die Chloridionen an den acht Ecken des Würfels sitzen. Dann befindet sich das Caesiumion genau in der Mitte des Würfels. Man kann alternativ auch eine Einheitszelle wählen, bei der sich die Caesiumionen auf den Eckplätzen des Würfels befinden und das Chloridion in der Mitte der Zelle. Die Caesiumchloridstruktur mit der relativ hohen Koordinationszahl acht wird bei Alkalimetallhalogeniden nur gebildet, wenn das Kation relativ groß ist, so dass es auch von acht Anionen umgeben werden kann. Sonst bildet sich die Natriumchlorid-Struktur. Auch Messing mit Zinkgehalten um 50 % hat bei Temperaturen unter 468 °C die Caesiumchloridstruktur.
Anwendung
Caesiumchlorid wird oft in Laborprozessen zur Aufreinigung von Nukleinsäuren oder Viren mit Hilfe einer Ultrazentrifuge verwendet. Dabei bildet sich nach mehrstündiger Ultrazentrifugation ein Dichtegradient selbständig aus. Die Partikel sammeln sich dann entsprechend ihrer Dichte in charakteristischen Banden im Zentrifugenröhrchen und können separat entnommen werden.
Darüber hinaus wird es in der Atomabsorptionsspektrometrie als Ionisationspuffer von leicht ionisierbaren Metallen verwendet.
Quellen
Wikimedia Foundation.

