- Disproportionieren
-
Bei der chemischen Reaktion der Disproportionierung, Syn. Dismutation, tritt im Rahmen einer Redoxreaktion ein Element gleichzeitig als Oxidationsmittel und als Reduktionsmittel auf, so dass es vorher in einer mittleren Oxidationsstufe, nachher teils in einer positiveren und teils in einer negativeren Oxidationsstufe vorliegt. Die Atome werden also teils oxidiert, teils reduziert. Der umgekehrte Fall nennt sich Komproportionierung oder Synproportierung.
Beispiel
Ein Beispiel ist die Reaktion von Chlor in Natronlauge. Dabei wird eines der beiden Chlor-Atome des Chlormoleküls mit der Oxidationszahl 0 zum Chlorid-Ion mit der Oxidationszahl −I reduziert, das andere Chlor-Atom zu der Oxidationsstufe +I (Hypochlorit-Ion) oxidiert.
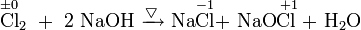
- Chlor reagiert in kalter Natronlauge zu Natriumchlorid, Natriumhypochlorit und Wasser.
In warmer Natronlauge reagiert Natriumhypochlorit weiter zu Natriumchlorat.
Siehe auch
Wikimedia Foundation.
