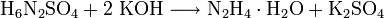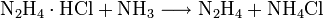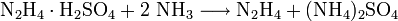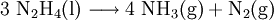- N2H4
-
Strukturformel 
Allgemeines Name Hydrazin Andere Namen - Diamid
- Diazan
Summenformel N2H4 CAS-Nummer 302-01-2 PubChem 9321 Kurzbeschreibung farblose, klare Flüssigkeit [1] Eigenschaften Molare Masse 32,05 g·mol−1 Aggregatzustand flüssig
Dichte 1,01 g·cm−3 (20 °C) [1]
Schmelzpunkt 1,5 °C [1]
Siedepunkt 113,5 °C [1]
Dampfdruck pKs-Wert 8,0 [2]
Löslichkeit mischbar mit Wasser [1], gut in Alkohol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 10-23/24/25-34-43-45-50/53 S: 45-53-60-61 MAK Nicht eingestuft, da cancerogen im Tierversuch [1]
WGK 3 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Hydrazin ist eine Stickstoffverbindung mit der Summenformel N2H4. Es ist eine farblose, ölige, ähnlich wie Ammoniak riechende, an Luft rauchende Flüssigkeit. Es verbrennt mit einer kaum sichtbaren Flamme. In den Handel kommt es meist als wässrige Lösung oder als Hydrazinhydrat (H2N−NH2 · H2O).
Inhaltsverzeichnis
Darstellung
Technisch
Technisch gibt es mehrere Wege zur Synthese von Hydrazin:[4]
- Raschig-Synthese: Oxidation von Ammoniak (NH3) mit Natriumhypochlorit.
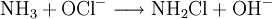
- Ammoniaklösung und Hypochloritionen reagieren rasch zu Chloramin und Hydroxidionen.
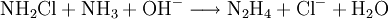
- Mit hohem Druck wird Ammoniakgas im Überschuss in die Lösung gepresst, dabei erwärmt sich diese auf ca. 400 K, und es erfolgt die Weiterreaktion zu Hydrazin.
- Bayer-Prozess: Oxidation von Ammoniak mit Natriumhypochlorit in Gegenwart von Aceton.
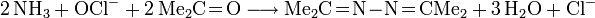
- Ammoniak bildet mit Aceton ein Ketazin, das Kondensationsprodukt eines Ketons mit Hydrazin.
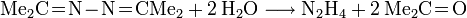
- Das Ketazin lässt sich bei 8-12 bar und 180°C zu Hydrazin hydrolysieren.
- Pechiney-Ugine-Kuhlmann-Prozess: Das technisch verstärkt angewandte Verfahren besteht in der Oxidation von Ammoniak mit Wasserstoffperoxid (H2O2) in Anwesenheit von Methylethylketon als Ketazinbildner sowie Acetamid und Natriumdihydrogenphosphat als Aktivatoren.
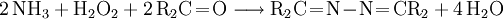
- Ammoniak reagiert mit dem Keton zu einem Ketazin und Wasser.
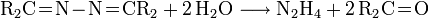
- Das erhaltene Ketazin kann wie beim Bayer-Prozess durch Hydrolyse leicht in Hydrazin überführt werden.
- Die Vorteile gegenüber dem Raschig- und Bayer-Prozess sind ein geringerer Energieverbrauch und das Fehlen anfallender Chloride.
Im Labor
- Durch Einleiten von Chlor in eine 20%ige Harnstofflösung und anschließender Zugabe von 20%iger Natronlauge. Die Ausbeute liegt bei etwa 50%.
- Der mechanistische Ablauf ist derselbe wie der der Hofmann-Umlagerung: Zuerst Bildung des Amidations durch Deprotonierung, dann elektrophile Halogenierung des Amidations, gefolgt von der zweiten Deprotonierung. Das Chloramidation zerfällt spontan zum Acylnitren und einem Chloridion. Das Acylnitren lagert sich zum Isocyanat um, welches unter Addition von Wasser die unbeständige Carbamidsäure liefert, die dann zu Kohlendioxid und Hydrazin zerfällt. Das entstandene Kohlendioxid wird unter Bildung von Natriumcarbonat von der Natronlauge aufgenommen.
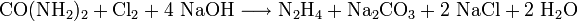
- Harnstoff, Chlor und Natriumhydroxidlösung reagieren zu Hydrazin, Natriumcarbonat und Natriumchlorid.
- Das Monohydrat kann ebenfalls aus trockenem Hydraziniumsulfat und Kaliumhydroxid durch Zugabe von Wasser und anschließender Destillation in einer Ausbeute von 25% der Theorie erhalten werden:
- Zu 99,5% wasserfreies Hydrazin entsteht bei der fraktionierten Destillation des Monohydrats mit Natriumhydroxid im Stickstoffstrom.
- Eine weitere Möglichkeit zur Herstellung trockenen Hydrazins ist die Spaltung von Hydrazinium-Salzen mit Ammoniak:[5]
Eigenschaften
Hydrazin weist eine dynamische Viskosität von 0,9·10-3 Pa·s auf. Reines Hydrazin kann beim Erhitzen explosionsartig zu Ammoniak und Stickstoff disproportionieren.
Konzentrierte Lösungen sind in Verbindung mit anderen Oxidationsmitteln hochexplosiv, teilweise hypergol. Hydrazin kann auch katalytisch zersetzt werden.
Salze
Hydrazin ist eine zweiwertige Base (pKb1 = 6,07; pKb2 = 15), jedoch schwächer als Ammoniak pKb = 4,75). Es reagiert als zweiwertige Base mit Säuren zu zwei Reihen von Hydraziniumsalzen (Name analog zum Ammonium) mit der allgemeinen Zusammensetzung [H2N−NH3]+X− und [H3N−NH3]2+2X−. Mit Salzsäure bildet sich Hydraziniummonochlorid ([H2N−NH3]Cl) und Hydraziniumdichlorid ([H3N−NH3]Cl2). Mit Schwefelsäure bildet sich Hydraziniumsulfat ([H3N−NH3]SO4) und Dihydraziniumsulfat ([H2N-NH3]2SO4.
Verwendung
Brennstoff
Aufgrund seiner hochreaktiven Eigenschaften verwendet man Hydrazin vor allem als Raketentreibstoff, der mit den Oxidatoren Distickstofftetroxid oder Salpetersäure eine hypergole Treibstoffkombination bildet. Auch allein wird Hydrazin in Korrekturtriebwerken verwendet, wo es katalytisch zersetzt wird.
Hydrazin wird als lagerfähiger Treibstoff in vielen Satelliten und Raumsonden verwendet. Dies kann zu einer erheblichen Umweltgefahr führen, wenn ein Raketenstart misslingt. Hat ein Satellit bereits eine Umlaufbahn erreicht, ist es aufgrund der hohen Geschwindigkeit von mindestens acht Kilometer pro Sekunde und der ungünstigen aerodynamischen Verhältnisse bei den kugelförmigen Tanks praktisch ausgeschlossen, dass diese auf dem Erdboden aufschlagen.
Vielmehr verglühen die Tanks samt Treibstoff schon in hohen Luftschichten unmittelbar nach dem Wiedereintritt in die Atmosphäre. Bei diesen Temperaturen zersetzt sich Hydrazin von selbst. Auch bei der Challenger-Katastrophe wurde keine Hydrazin-Kontamination festgestellt. Nach einer erfolgreichen Shuttle-Landung ist hingegen eine der ersten Sicherheitsmaßnahmen, den zur Ruhe gekommenen Orbiter auf austretende giftige Raketentreibstoffe wie Hydrazin zu untersuchen. Erst wenn dieser Test Entwarnung gibt, dürfen sich weitere Hilfsfahrzeuge, etwa zur Kühlung, dem Shuttle nähern.
Hydrazin wird ebenfalls in Luftfahrzeugen wie der F-16 als Brennstoff für ein Notenergieaggregat mitgeführt.[6]
Des Weiteren dient Hydrazin zur elektrochemischen Stromerzeugung in Sekundärzellen oder in alkalischen Brennstoffzellen vor allem in der Raumfahrt, U-Booten und anderer Militärtechnik.
Reduktionsmittel / Korrosionsinhibitor
Verdünnte Hydrazin-Lösungen werden auch als Reagenzien im Labor sowie zur Deoxigenierung (Befreiung von Sauerstoff) von Kesselspeisewasser in Dampfkraftwerken eingesetzt. Die Verwendung erfolgt sowohl für die Entfernung des Restsauerstoffes nach Speisewasserentgasung, zum Schutz gegen mögliche geringe Sauerstoffeinbrüche im Bereich des Kondensators wie auch für die katalytische Sauerstoffentfernung aus dem Zusatzwasser. Der Vorteil von Hydrazin ist, dass nur Stickstoff und Wasser bei dieser Reaktion entstehen.[7] Neben der Deoxigenierung wird auch eine Anhebung des pH-Wertes im Wasser-Dampf-Kreislauf erreicht.
In der chemischen Synthese wird Hydrazin vor allem als starkes Nukleophil (sogenannter alpha-Effekt) und als Reduktionsmittel (Entstehen von Stickstoff, vgl. Wolff-Kishner-Reaktion) verwendet.
Sicherheitshinweise
Hydrazin ist giftig, im Tierversuch krebserzeugend und wirkt hochtoxisch auf Wasserorganismen. Hydrazin wird auch über die Haut resorbiert. Hydrazin hat eine Technische Richtkonzentration von 0,13 mg·m−3.
Derivate
- 1,1-Dimethylhydrazin (UDMH)
- 1,2-Dimethylhydrazin
- Monomethylhydrazin (MMH)
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 302-01-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. Februar 2008 (JavaScript erforderlich)
- ↑ Charles E. Mortimer: Chemie – Das Basiswissen der Chemie. Thieme 2003, ISBN 3-13-484308-0
- ↑ Eintrag zu CAS-Nr. 302-01-2 im European chemical Substances Information System ESIS
- ↑ A.F.Holleman, E.Wiberg. Lehrbuch der Anorganischen Chemie. Walter de Gruyter & Co. Berlin 1995, 101. Auflage, ISBN 3-11-012641-9
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 469-72.
- ↑ General Flugsicherheit in der Bundeswehr (Hrsg.): Hilfe bei Flugunfällen (Auflage 2004, PDF 2,8 MB). Auflage 2005: S. 10.
- ↑ K. Hancke, S. Wilhelm: Wasseraufbereitung: Chemie und chemische Verfahrenstechnik. Spinger, 2003, S. 249. ISBN 3-540-06848-1
Wikimedia Foundation.