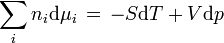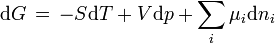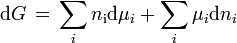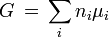- Gibbs-Duhem-Beziehung
-
Die Gibbs-Duhem-Gleichung (nach Josiah Willard Gibbs und Pierre Duhem) beschreibt den Zusammenhang zwischen den Änderungen der chemischen Potentiale der Komponenten i eines thermodynamischen Systems.
Das als Gibbs-Duhem-Gleichung bezeichnete vollständige Differential des chemischen Potentials,
folgt durch Vergleich des vollständigen Differentials des Gibbs-Potentials (freien Enthalpie) G,
mit
dem vollständigen Differential von
Die Gibbs-Duhem-Gleichung ist von großem Interesse für die Thermodynamik, da sie aufzeigt, dass in einem thermodynamischen System nicht alle intensiven Variablen (Variablen, die nicht von der Menge einer Substanz abhängen, wie z. B. Temperatur, Druck, Dichte, etc.) unabhängig voneinander veränderlich sind. Nimmt man die Temperatur T und den Druck p als veränderlich an, so können nur noch i − 1 der i Komponenten voneinander unabhängige chemische Potentiale aufweisen. Hieraus folgt die Gibbs'sche Phasenregel, die die Anzahl der möglichen Freiheitsgrade für dieses System angibt.
Oft wird die Gibbs-Duhem-Gleichung bei isothermer, isobarer Prozessführung verwendet. Es folgt dann
∑ nidμi = 0 i Die Summe der Produkte aus der Veränderung des chemischen Potenzials μi und der Stoffmenge ni der einzelnen Komponenten ist also bei einem solchen Prozess konstant.
Wikimedia Foundation.