- Halogenisierung
-
Als Halogenierung wird der Austausch (Substitution) eines Wasserstoffatoms in einem Molekül durch ein Atom der 7. Hauptgruppe (Halogene) bezeichnet. Die Endprodukte werden auch organische Halogene genannt.
Für genauere Beschreibungen der Mechanismen siehe die Artikel Bromierung, Chlorierung, Fluorierung bzw. Iodierung (Organische Chemie).
Halogenierung von Aromaten
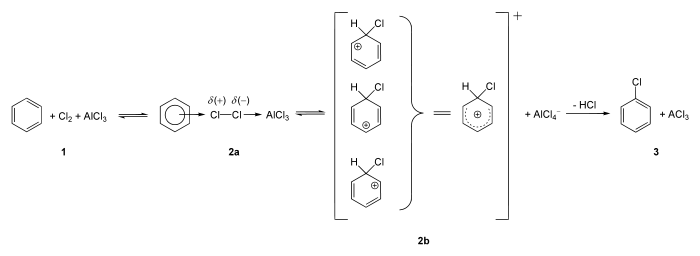
Aromaten wie Benzol und seine (substituierten) Derivate erweisen sich als sehr stabil gegenüber Halogenierungen. Eine Chlorierung oder Bromierung des Benzols findet nur statt, wenn man als Katalysator eine Lewissäure wie Aluminiumchlorid (AlCl3) verwendet. Wenn man Chlor in Benzol einleitet findet gar keine Reaktion statt, weil die Cl–Cl-Bindung des Chlormoleküls durch die π-Elektronen des Benzols nicht genügend polarisiert wird, um eine C–Cl-σ-Bindung zu knüpfen, welche das π-System selbst aufbrechen würde.
Erst die Anwesenheit des Katalysators Aluminiumchlorid (1, siehe unteres Bild) bzw. auch Eisenchlorid (FeCl3) startet die Reaktion. Der Grund hierfür liegt darin, dass Lewis-Säuren als Elektronenakzeptor fungieren und dadurch in der Lage sind, das Cl2-Molekül zu polarisieren (2a).
Cl2 + AlCl3 → Clδ+ ······ Clδ− ·····AlCl3
Die entstehende Verbindung enthält ein positiv polarisiertes Chloratom, welches im Folgeschritt als Elektrophil wirkt und damit das Benzol attackieren kann. Dabei entsteht ein Wheland-Komplex als Zwischenstufe (2b), welche unter Protonenabspaltung im darauffolgenden Reaktionsschritt wieder rearomatisiert wird (3).
Analog zu diesem Mechanismus findet auch die Bromierung statt, z. B. mit Br2/AlBr3. Eine Fluorierung oder Iodierung des Benzols kann unter diesen Bedingungen allerdings nicht ablaufen. In der Umwelt kann unter anaeroben Bedingungen die Umkehrreaktion, die reduktive Dehalogenierung, auftreten.
Literatur
- Marye Anne Fox, James K. Whitesell: Organische Chemie, Grundlagen, Mechanismen, bioorganische Anwendungen, Spektrum, Akad. Verl., 1995, ISBN 3-86025-249-6
Wikimedia Foundation.