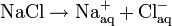- Hydratsphäre
-
Dieser Artikel wurde aufgrund von Mängeln auf der Qualitätssicherungsseite der Redaktion Chemie eingetragen. Dies geschieht, um die Qualität der Artikel aus dem Themengebiet Chemie auf ein akzeptables Niveau zu bringen. Dabei können Artikel gelöscht werden, die nicht signifikant verbessert werden können. Hilf mit, die Mängel dieses Artikels zu beseitigen, und beteilige dich an der Diskussion. Unter Hydratation oder Hydration, versteht man
- die Anlagerung von Wassermolekülen an gelöste Ionen. Dadurch entsteht eine Hydrathülle (auch als Hydrat-Sphäre bezeichnet).
- die Anlagerung von Wassermolekülen an polare Neutralmoleküle, insbesondere wenn Wasserstoffbrückenbindungen gebildet werden können
- die Anlagerung von Wassermolekülen in Festkörper (Mineralien) als Kristallwasser
Der Begriff ist nicht zu verwechseln mit der Hydratisierung, bei der eine chemische Reaktion von Wasser an einem Substrat stattfindet und der Hydrierung, welche die Addition von Wasserstoff beschreibt.
Anlagerung von Wassermolekülen an Ionen in Lösung
Die bei der Hydratation entstehenden Produkte heißen Hydrate. In anderen Lösungsmitteln, z. B. Ammoniak, treten ähnliche Effekte auf, die allgemein Solvatisierung genannt werden.
Die Hydratation erfolgt aufgrund der elektrostatischen Kräfte zwischen den geladenen Ionen und den Wasser-Dipolen (Ion-Dipol-Wechselwirkung). Unter Ausbildung von Wasserstoffbrücken zu der ersten Hydrathülle können sich weitere Wassermoleküle anlagern und so eine weitere Hydrat-Sphäre bilden.
Als Maß für die Neigung der Ionen, sich mit Wassermolekülen zu verbinden, dient die Hydrationsenergie. Dies ist die Energie, die erforderlich ist, um die Ionen aus der wässrigen Lösung in das Vakuum zu bringen.
Die Anzahl der gebundenen Wassermoleküle und die Stärke der Bindung hängen von der Größe und der Ladung der Ionen ab. Bei gleicher Ladung bauen die kleineren Ionen eine größere Hydrathülle auf als die größeren. Durch ein "aq" am Ion markiert man, dass das Ion hydratisiert vorliegt:
Anionen sind im Allgemeinen wesentlich größer als Kationen und damit auch schwächer hydratisiert.
Siehe auch
Wikimedia Foundation.