- Hydrazide
-
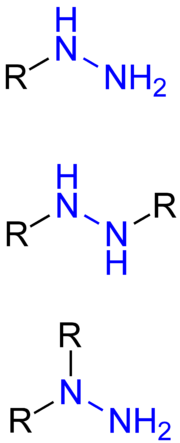 Beispiele für organische Hydrazine mit der blau markierten funktionellen Gruppe: Monoorganylhydrazin (oben), symmetrisches Diorganylhydrazin (Mitte) und unsymmetrisches Diorganylhydrazin (unten). R ist ein Organyl-Rest (Alkyl-Rest, Aryl-Rest, Alkylaryl-Rest, etc.). In den organischen Hydraziden ist mindestens einer der Reste R ein Acyl-oder ein Sulfonyl-Rest.
Beispiele für organische Hydrazine mit der blau markierten funktionellen Gruppe: Monoorganylhydrazin (oben), symmetrisches Diorganylhydrazin (Mitte) und unsymmetrisches Diorganylhydrazin (unten). R ist ein Organyl-Rest (Alkyl-Rest, Aryl-Rest, Alkylaryl-Rest, etc.). In den organischen Hydraziden ist mindestens einer der Reste R ein Acyl-oder ein Sulfonyl-Rest.
Hydrazide sind eine Klasse von organischen Verbindungen, die eine gemeinsame funktionelle Gruppe aufweisen. Diese besteht aus zwei Stickstoffatomen, die über eine kovalente Bindung verknüpft sind und vier Substituenten aufweisen, von denen mindestens einer eine Acylgruppe ist. Eine verwandte Verbindungsklasse, die Hydrazine[1], weisen keine Acylgruppe auf. Viele organische Hydrazine gelten als giftig, ggf. sogar als carcinogen.[2]
Phenylhydrazin und 2,4-Dinitrophenylhydrazin werden als Reagenz zum chemischen Nachweis von Carbonylgruppen in Aldehyden und Ketonen benutzt[3], wobei sich die entsprechenden Phenylhydrazone bzw. 2,4-Dinitrophenylhydrazone bilden. 1,2-Diphenylhydrazin unterliegt in saurer Lösung der Umlagerung zu Benzidin. Tetraphenylhydrazin ist eine farblose kristalline Verbindung, die sich in Benzol mit grüner Farbe löst. Ursache ist dabei die Dissiziation zu Diphenylstickstoff, einem mesomeriestabilisierten freien Radikal. Zu den Hydraziden zählen die Sulfonylhydrazide, wie zum Beispiel p-Toluolsulfonylhydrazid, die nützliche Reagenzien in der organischen Chemie sind, beispielsweise bei der Shapiro-Reaktion. Dieses Reagenz kann durch die Umsetzung von Tosylchlorid mit Hydrazin dargestellt werden.[4]
Anorganische Hydrazide
Vom Hydrazin (NH2–NH2) abgeleitete salzartige Verbindungen wie Natriumhydrazid (NaNH–NH2) zersetzen sich bei Zutritt von Luft oder Feuchtigkeit unter Explosion. Anorganische Hydrazide erhält man durch Umsetzung von Metallen oder Metallverbindungen mit Hydrazin. [5]
Einzelnachweise
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, Seite 165−167, ISBN 3-7776-0406-2.
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, Frank'sche Verlagshandlung, Stuttgart, 1983, 8. Auflage, S. 1781, ISBN 3-440-04513-7.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 523, ISBN 3-342-00280-8.
- ↑ Synthesevorschrift in Organic Syntheses Coll. Vol. 5, 1973, S. 1055; Band 40, 1960, S. 93.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 557 .
Weblinks
- Definition der Verbindungsklasse im IUPAC Gold Book (PDF, engl.; 9 kB)
Wikimedia Foundation.
