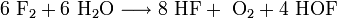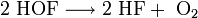- Hydroxylfluorid
-
Strukturformel 
Allgemeines Name Hypofluorige Säure Andere Namen - Unterfluorige Säure
- Hydroxylfluorid
Summenformel HFO CAS-Nummer 14034-79-8 PubChem 123334 Kurzbeschreibung < −117 °C weißer Feststoff, > −117 °C gelbliche Flüssigkeit[1] Eigenschaften Molare Masse 36,01 g·mol−1 Schmelzpunkt Siedepunkt 10–20 °C [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Als Hypofluorige Säure, selten auch Hydroxylfluorid oder veraltet Unterfluorige Säure genannt, bezeichnet man die einzige bekannte Sauerstoffsäure des Fluors. Sie besitzt die Summenformel HOF. Ihre Salze würden als Hypofluorite bezeichnet, sind jedoch unbekannt. Formal besitzt Sauerstoff in dieser Verbindung die Oxidationsstufe 0.
Inhaltsverzeichnis
Gewinnung und Darstellung
Hypofluorige Säure entsteht in geringen Mengen neben Flusssäure und Sauerstoff bei der Reaktion molekularen Fluors mit Eis bei −40 °C. Durch Ausfrieren in einer mit flüssigem Stickstoff gekühlten Kühlfalle kann sie als weißer Feststoff erhalten werden.
Bei dieser Reaktion entsteht Hypofluorige Säure effektiv jedoch nicht in dieser Stöchiometrie, da ein großer Teil der gebildeten Säure sofort weiter reagiert und nur der kleinere Teil erhalten werden kann.
Eigenschaften
Physikalische Eigenschaften
Hypofluorige Säure ist gewinkelt aufgebaut (Bindungswinkel von 97,2°). Die Bindungslänge O–H beträgt 96,4 pm, die von O–F 144,2 pm.[3]
Chemische Eigenschaften
Hypofluorige Säure ist nicht stabil und zersetzt sich unter Bildung von Flusssäure und Sauerstoff.
Sie ist ein sehr starkes Oxidationsmittel.
Die Salze des Hypofluorigen Säure sind unbekannt. Lediglich von der protonierten Form der freien Säure (H2OF+) können wenige Salze auf aufwendigem Wege erhalten werden.
Einzelnachweise
- ↑ a b c Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102 Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102 Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 466.
Wikimedia Foundation.