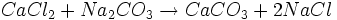- Ammoniak-Soda-Verfahren
-
Das Solvay-Verfahren oder auch Ammoniak-Soda-Verfahren ist ein chemischer Prozess zur Herstellung von Natriumcarbonat; Na2CO3. Es wurde 1865 von Ernest Solvay entwickelt und löste das bis dahin verwendete Leblanc-Verfahren ab.
Inhaltsverzeichnis
Bilanz
Der Prozess geht von den billigen und in großen Mengen vorhandenen Rohstoffen Kalk ("Calciumcarbonat") und Kochsalz ("Natriumchlorid") aus, jedoch läuft die Reaktion zu Soda und Calciumchlorid nicht freiwillig ab, denn die Umkehrreaktion (mit Calciumcarbonat und Natriumchlorid als Produkte) ist thermodynamisch bevorzugt:
Im Solvay-Verfahren wird sie aber über einen Umweg realisiert:
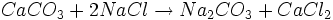
- (Diese Bilanz ergibt sich aus der Addition der einzelnen Reaktionsgleichungen (siehe Verfahren), wobei die zweite Gleichung doppelt gezählt wird.)
Das Solvay-Verfahren arbeitet außerdem ohne die große Umweltbelastung des Leblanc-Verfahrens, da das Ammoniak in einem geschlossenen Kreislauf zirkuliert. Ein Nachteil ist jedoch, dass das Solvay-Verfahren große Mengen an Wasser verbraucht und pro Kilo Soda etwa 1 Kilo Calciumchlorid ins Abwasser emittiert (die großen Flüsse oder die Meere), das sind bei 1 Million Tonnen Soda (wie es leistungsstarke Solvay-Werke pro Jahr produzieren) etwa 1 Million Tonnen Calciumchlorid (etwa 3 komplette Güterzüge zu je 1000 Tonnen pro Tag). Das entstehende CaCl2 wird zudem nicht besonders häufig benötigt.
Das Verfahren
Die einzelnen Schritte des Verfahrens:
1.) Der Kalk wird gebrannt:
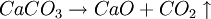
- Calciumcarbonat zersetzt sich in der Hitze zu Calciumoxid ("Gebrannter Kalk") und Kohlendioxid.
2.) Kohlendioxid wird zusammen mit Ammoniak in eine konzentrierte Kochsalzlösung eingeleitet. Hierbei fällt Natriumhydrogencarbonat aus, das von der entstehenden Ammoniumchloridlösung getrennt wird.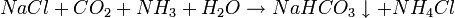
- Kochsalz reagiert mit Kohlendioxid, Ammoniak und Wasser zu Ammoniumchlorid ("Salmiak") und Natriumhydrogencarbonat ("Natron").
- Die einzelnen Teilschritte:
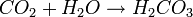
- Kohlendioxid und Wasser reagieren zu Kohlensäure...
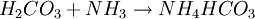
- ...die wiederum mit Ammoniak zu Ammoniumhydrogencarbonat...
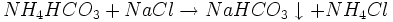
- ...das wiederum reagiert dann mit Kochsalz zu Natriumhydrogencarbonat ("Natron") und Ammoniumchlorid ("Salmiak").
3.) Das Natriumhydrogencarbonat wird auf ca. 200 °C erhitzt, wobei Wasser und Kohlendioxid entweichen. Übrig bleibt dann das Produkt Soda. Dieser Vorgang wird als Kalzinierung (kalzinieren) bezeichnet.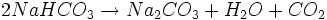
- Natriumhydrogencarbonat spaltet in der Hitze Wasser und Kohlendioxid ab, wodurch Soda entsteht.
4.) Im vierten Schritt wird das Ammoniak wiedergewonnen und Schritt 2 zugeführt: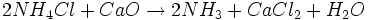
- Das Ammoniumchlorid aus Reaktion 2 wird mit dem gebrannten Kalk aus Reaktion 1 zu Ammoniak, Calciumchlorid und Wasser umgesetzt.
Siehe auch
Weblinks
Wikimedia Foundation.