- Calciumchlorid
-
Kristallstruktur 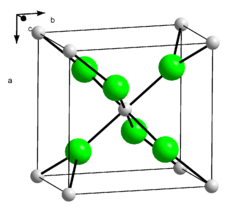
__ Ca2+ __ Cl- Allgemeines Name Calciumchlorid Andere Namen - Kalziumchlorid
- E 509
Verhältnisformel CaCl2 CAS-Nummer - 10043-52-4 (wasserfrei)
- 10035-04-8 (Dihydrat)
- 25094-02-4 (Tetrahydrat)
- 07774-34-7 (Hexahydrat)
ATC-Code Kurzbeschreibung farb- und geruchlose, hygroskopische Kristalle [1]
Eigenschaften Molare Masse - 110,98 g·mol−1 (wasserfrei)
- 147,02 g·mol−1 (Dihydrat)
- 183,04 g·mol−1 (Tetrahydrat)
- 219,08 g·mol−1 (Hexahydrat)
Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt > 1600 °C[1]
Löslichkeit gut in Wasser (740 g·l−1 bei 20 °C)[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 
Achtung
H- und P-Sätze H: 319 EUH: keine EUH-Sätze P: 305+351+338 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Reizend (Xi) R- und S-Sätze R: 36 S: (2)-22-24 LD50 1000 mg·kg−1 (Ratte, oral) [3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumchlorid (auch Kalziumchlorid) ist ein Chlorid des Erdalkalimetalls Calcium mit der Summenformel CaCl2. Calcium liegt dabei in der Oxidationsstufe +2 vor, Chlor hat die Oxidationstufe −1.
Inhaltsverzeichnis
Geschichte
Um 1860 gelang den Chemikern Robert Wilhelm Bunsen und Augustus Matthiessen die erste Reindarstellung des Elementes Calcium durch Schmelzelektrolyse von Calciumchlorid.
Vorkommen
Calciumchlorid kommt in der Natur gelöst in Salzsolen vor.
Wasserhaltiges Calciumchlorid bildet die seltenen Minerale Sinjarit (Dihydrat) und Antarcticit (Hexahydrat). Das Anhydrid kommt als Hydrophilit vor.
Gewinnung und Darstellung
Calciumchlorid wird aus Salzsäure und Calciumcarbonat hergestellt:
Anschließendes Erhitzen auf 260 °C liefert die wasserfreie Form.
Technisch wird Calciumchlorid als Abfallprodukt bei der Sodaherstellung nach dem Solvay-Verfahren – und zwar bei der Rückgewinnung des Ammoniaks aus dem dabei entstandenen Ammoniumchlorid – erhalten:
Eigenschaften
Calciumchlorid ist ein Salz. Calcium und Chlor liegen aufgrund des großen Elektronegativitätsunterschiedes ionisch vor. Die Bindung erfolgt somit über elektrostatische Wechselwirkungen. Calciumchlorid bildet farblose Kristalle, die eine verzerrte Rutil-Struktur ausbilden.
Calciumchlorid bildet in Reinform farblose Kristalle und ist in wasserfreiem Zustand stark hygroskopisch. Es nimmt leicht Wasser aus der Umgebung auf und bildet dabei einen Hydrat-Komplex.
Das wasserfreie Calciumchlorid löst sich in Wasser exotherm.
Reaktionen
Calciumchlorid reagiert mit Wasser unter Bildung eines Hexahydrat-Komplexes und starker Wärmeentwicklung (exotherm, ΔH < 0):
Die Kristalle des Hexahydrats lösen sich bei ungefähr 30 °C im eigenen Kristallwasser. Erhitzen auf ungefähr 200 °C setzt das gebundene Wasser wieder frei. Das Auflösen in Wasser führt im Gegensatz zu wasserfreiem Calciumchlorid zu einer starken Abkühlung. Beide Calciumchlorid-Formen sind zudem gut löslich in Ethanol.
Abspaltung von Kristallwasser bei CaCl2·2 H2O in der Differential-Thermoanalyse
Verwendung
Wasserfreies Calciumchlorid ist aufgrund seiner Hygroskopie ein wichtiges Trocknungsmittel im Labor, beispielsweise im Exsikkator, und in der technischen Chemie für Gase und Flüssigkeiten. Anwendungsfelder sind die Trocknung von Wohnräumen, der Einsatz als Frostschutzmittel, im speziellen als Frostschutzmittel und Abbindebeschleuniger im Beton, sowie als Staubbindemittel (z. B. auf Baustellen und als Besatz bei Sprengarbeiten).
Es wird als Festigungsmittel, Geschmacksverstärker und Stabilisator eingesetzt (unter anderem bei der Trinkwasseraufbereitung, Oberflächenbehandlung von Obst). Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 509 zugelassen.
Unter Ausnutzung der exothermen Hydratation bei der Reaktion mit Wasser findet Calciumchlorid Einsatz zur Erwärmung von Fertiggetränken. Darüber hinaus kommt es als Streusalz sowie zur Herstellung von Kältemischungen zum Einsatz (siehe oben).
Weiterhin dient es zur Gerinnung von Eiweißen in der Lebensmitteltechnologie und findet Anwendung bei der Herstellung von Produkten wie Tofu oder künstlichem Kaviar.
Zudem dient es in der Molekularbiologie zur Herstellung kompetenter Zellen. Calciumionen verändern hierbei die Permeabilität der Zellmembran und steigern so das Aufnahmepotenzial der Zelle für DNA.
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Calciumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2.1.2008 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 10043-52-4 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Calcium chloride anhydrous bei ChemIDplus
CalciumhalogenideCalciumfluorid | Calciumchlorid | Calciumbromid | Calciumiodid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Calciumchlorīd — (Chlorcalcium) CaCl2 findet sich im Meerwasser und in vielen Mineralwässern, bildet mit Chlormagnesium das Mineral Tachydrit, mit phosphorsaurem Kalk den Apatit und entsteht beim Behandeln von kohlensaurem Kalk mit Salzsäure. Als Nebenprodukt… … Meyers Großes Konversations-Lexikon
Calciumchlorid [1] — Calciumchlorid (Chlorcalcium) CaCl2, Mol. Gew. 111, spez. Gew. des geschmolzenen wasserfreien Salzes 2,21. Schmelzpunkt 720–730°. Je nach der Darstellung bildet es entweder eine weiße poröse, zusammengesinterte oder eine glasige, schwach… … Lexikon der gesamten Technik
Calciumchlorid [2] — Calciumchlorid findet man wegen seiner Eigenschaft, Wasser aus der Luft anzuziehen, also feucht zu halten, in sehr vielen als Staubbindemittel in den Handel gebrachten Präparaten. Mezger … Lexikon der gesamten Technik
Calciumchlorid — Cạl|ci|um|chlo|rid 〈[ klo ] n. 11; fachsprachl.〉 = Kalziumchlorid * * * Cal|ci|um|chlo|rid: CaCl2; farblose, hygroskopische Kristalle, Smp. 30 °C (als Hexahydrat), 772 °C (wasserfrei), die in Trockenmitteln, Streusalz, Staubbindemitteln u.… … Universal-Lexikon
Calciumchlorid — Cạl|ci|um|chlo|rid 〈[ klo: ] n.; Gen.: (e)s, Pl.: e; Chemie〉 hygroskop. Abfallprodukt beim Ammoniaksodaverfahren; oV ; Syn. Chlorcalcium … Lexikalische Deutsches Wörterbuch
CaCl2 — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Calciumchlorid Andere Namen Kalziumchlorid E 509 Verhältnisformel CaCl2 … Deutsch Wikipedia
Chlorcalcium — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Calciumchlorid Andere Namen Kalziumchlorid E 509 Verhältnisformel CaCl2 … Deutsch Wikipedia
E509 — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Calciumchlorid Andere Namen Kalziumchlorid E 509 Verhältnisformel CaCl2 … Deutsch Wikipedia
E 509 — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Calciumchlorid Andere Namen Kalziumchlorid E 509 Verhältnisformel CaCl2 … Deutsch Wikipedia
Kalziumchlorid — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Calciumchlorid Andere Namen Kalziumchlorid E 509 Verhältnisformel CaCl2 … Deutsch Wikipedia





