- Natriumhydrogencarbonat
-
Strukturformel 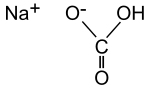
Allgemeines Name Natriumhydrogencarbonat Andere Namen - Natriumhydrogenkarbonat
- (doppeltkohlensaures) Natron
- Natriumbicarbonat
- Natriumbikarbonat
- Bikarbonat
- Backsoda
- Bullrich-Salz
- E 500ii
Summenformel NaHCO3 CAS-Nummer 144-55-8 Kurzbeschreibung farbloser, geruchloser, kristalliner Feststoff
Eigenschaften Molare Masse 84,01 g·mol−1 Aggregatzustand fest
Dichte 2,22 g·cm−3 (20 °C)[1]
Schmelzpunkt Löslichkeit mäßig in Wasser (96 g·l−1 bei 20 °C)[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 4220 mg·kg−1 (oral, Ratte)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumhydrogencarbonat mit dem Trivialnamen Natron hat die Summenformel NaHCO3, ist ein Natriumsalz der Kohlensäure und zählt zu den Hydrogencarbonaten. Die Verbindung sollte nicht mit Natriumcarbonat, der Soda, mit der Summenformel Na2CO3, verwechselt werden.
Gelegentlich werden für Natriumhydrogencarbonat auch die veralteten und chemisch unzutreffenden Trivialnamen doppeltkohlensaures Natron und Natriumbicarbonat verwendet. Im Handel wird die Verbindung auch unter den Bezeichnungen Speisesoda, Backsoda, Speisenatron oder Kaisernatron angeboten.
Natriumhydrogencarbonat ist ein farbloser, kristalliner Feststoff, der sich oberhalb einer Temperatur von 50 °C unter Abspaltung von Wasser und Kohlenstoffdioxid zu Natriumcarbonat zersetzt.
Inhaltsverzeichnis
Etymologie
Das Wort Natron stammt in dieser Form aus dem Griechischen, ursprünglich aber aus dem Ägyptischen, wo der Konsonantenstamm „ntrj“ (= göttlich) für als heilig geltende Stoffe gebraucht wird, unter anderem für das im Wadi Natrun vorkommende natürliche Natron (eigentlich ein Gemisch aus Natron, Soda und Salz; ägyptisch sonst: hsmn) das zur rituellen Reinigung und zur Mumifizierung verwendet wurde. Der Elementname Natrium leitet sich von Natron ab.
Biologische Bedeutung
Mit Säuren reagiert es schäumend unter Bildung von Kohlenstoffdioxid und Wasser:

- Natriumhydrogencarbonat und Salzsäure reagieren zu Natriumchlorid, Kohlenstoffdioxid und Wasser.
Die Möglichkeit, Säuren durch HCO3− zu neutralisieren, ist für den Körper überlebenswichtig.
- Im Magen muss aufgrund der dort aktiven Enzyme ein saures Milieu herrschen, dies geschieht durch Produktion von Chlorwasserstoff (HCl), woraus sich zusammen mit Wasser die Magensäure (ca. 0,5 prozentige Salzsäure) bildet, deren pH-Wert (nüchtern) bis auf 1–1,5 sinken kann. Die Epithelzellen der Magenwand, die bei einem solch niedrigen pH-Wert sofort zugrunde gehen würden, schützen sich selbst durch Abgabe von mit HCO3− versetztem Schleim.[3] Dringen H+-Ionen der Salzsäure in die Schleimschicht ein, so werden sie zu CO2 und Wasser neutralisiert. Das CO2 entweicht zumeist durch die Speiseröhre.
- Im Dünndarm wird wiederum eine alkalische Umgebung benötigt, da hier andere Enzyme die Spaltung der Nährstoffe übernehmen. Die Änderung des pH-Wertes erfolgt im Zwölffingerdarm durch Einspeisung des Sekretes der Bauchspeicheldrüse, welches unter anderem ebenfalls - wie der im Magen abgegebene Schleim - HCO3− enthält.
- Hydrogencarbonat HCO3− ist der wichtigste Blutpuffer zur Regulierung des Säure-Basen-Haushalts des Menschen.
Anwendungen in der Industrie
Wegen der thermischen Zersetzung von Natriumhydrogencarbonat, einsetzend oberhalb von 50 °C, wird es seit langer Zeit in der Lebensmitteltechnik als Backtriebmittel (im Backpulver zusammen mit Natriumhydrogenphosphat oder Kaliumhydrogentartrat) und als Feuerlöschpulver genutzt.
Die thermische Zersetzung bei 200°C ist eine Schlüsselreaktion beim industriellen Solvay-Verfahren zur Herstellung von Soda (Natriumcarbonat).
Vorkommen
Natriumhydrogencarbonat kommt als natürliches Mineral Nahcolith in den USA vor. Die Verschwisterung mit Ölschiefer verhinderte aber eine industrielle Nutzung.
Herstellung
Umsetzung von gesättigter Natriumcarbonatlösung mit Kohlenstoffdioxid unter Kühlung:
Dies ist eine Gleichgewichtsreaktion, die aber durch die relative Schwerlöslichkeit von Natriumhydrogencarbonat stark nach rechts verschoben ist. Das abfiltrierte Natriumhydrogencarbonat muss vorsichtig getrocknet werden, damit es sich nicht wieder zersetzt (in Umkehrung der Bildungsreaktion).
Im Solvay-Verfahren als Zwischenprodukt ausfallendes Natriumhydrogencarbonat wird wegen der mitgefällten Verunreinigungen (hauptsächlich Ammoniumchlorid) normalerweise nicht verwendet.
Verwendung von Natron
- In der Lebensmitteltechnik
- Bestandteil von Backpulvern
- Bestandteil von Brausepulvern
- Bestandteil von Sodawasser
- In der Sportlerernährung
- bei geeigneter Anwendung und Dosierung bei gesunden, trainierten und nicht mangelernährten Menschen kann ein positiver Effekt auf die Ausdauer für belegt oder sehr wahrscheinlich angesehen werden[4]
- In der Medizin
- zum Zähneputzen (Natron bzw. baking soda ist wegen seines abrasiven Effekts in vielen Zahnpasten enthalten, vor allem in Ländern wie den USA)
- Als Mittel gegen Sodbrennen wegen der Neutralisationswirkung unter Bildung von ungiftigen Reaktionsprodukten (CO2 und Wasser); gilt heute als veraltet (siehe Antazidum, Protonenpumpenhemmer). NaHCO3 ist dennoch in vielen Produkten gegen Sodbrennen und säurebedingte Magenprobleme enthalten. Beispielsweise besteht das Bullrich-Salz zu 100% aus Natriumhydrogencarbonat.
- Bei Diabetikern zur Neutralisierung saurer Stoffwechselprodukte
- Als Antidot bei Vergiftungen durch Barbiturate, Salicylate und Trizyklische Antidepressiva[5]
- zur Behandlung der metabolischen Azidose
- als Deo-Ersatz und bei Schweißfüßen als Fußbad anwendbar
- Trägt man einen Brei aus Natron und Wasser auf einen Insektenstich auf, vermindern sich Juckreiz und Schwellung schnell.
- Bei starkem Sonnenbrand tränkt man ein T-Shirt in Natron-Wasser und zieht es nass über. Hervorragende schnelle und schmerzlindernde Wirkung.
- als Badezusatz bei Ekzemen, als Peeling bei Akne, und zur Behandlung von Fußpilz [1]
- als Zusatz bei der Dialyse
- als Bestandteil von Brausetabletten
- In der Umwelttechnik
- als Absorptionsmittel für saure Abgasbestandteile (SOx, Cl) in Rauchgasreinigungsanlagen (Bicar-Verfahren)
- Historisch zur Dehydratisierung von Leichen (Mumifizierung).
- In der Landwirtschaft
- Bestandteil von Feuerlöschpulvern
- zum Strecken von synthetischen Drogen wie Amphetamin sowie zur Herstellung von Crack aus Kokain
- Im Haushalt
- als Triebmittel
- zum Enthärten von Wasser (beispielsweise um Tee oder Kaffee zu kochen)
- als Putzmittel zum Entfernen verkrusteter Speisereste. Die Kruste auf dem Topfboden mit Natron überpudern, das Ganze über Nacht stehen lassen und am folgenden Morgen mit einer Tasse Wasser aufkochen, so lösen sich selbst sehr hartnäckige Verkrustungen, geeignet für Edelstahl- und Emailletöpfe, Thermoskannen, Teekannen, Blumenvasen.
- Eine Prise Natron im Kochwasser lässt Erbsen, Linsen und Bohnen schneller weich werden und nimmt verschiedenen Kohlsorten die blähende Wirkung.
- Als Beigabe zum fertigen Käsefondue macht es dieses leichter bekömmlich und luftig.
- Es neutralisiert Gerüche: Mundgeruch, Abflussrohre, muffige Schuhe, Kühlschrank, Katzentoilette, Kleintierkäfige …
- Überschüssige Säure in Lebensmitteln wird durch Natron neutralisiert oder abgeschwächt. Dies ist etwa bei der Zubereitung von Konfitüren aus sehr sauren Früchten (Sanddorn oder Rhabarber) von Bedeutung, da diese so einen milderen Geschmack erhalten und daher auch weniger Zucker verwendet werden muss. Auch zu einer Speise versehentlich übermäßig zugesetzter Essig oder Zitronensaft kann durch Natron neutralisiert werden.
Bei der Zugabe von Natriumhydrogencarbonat werden aus hartem Wasser Calcium- und Magnesiumionen als Carbonate ausgefällt:
Das weichere Wasser kann man dann nach Bodensatzbildung durch Abgießen, oder bereits vorher durch Filtrieren, von den Carbonaten trennen.
- In der Aquaristik.
- Erhöhung der Pufferkapazität zur Verhinderung eines Säuresturzes.
- In Spielzeugraketen dient es zusammen mit Essig als Treibstoff.
Einzelnachweise
- ↑ a b c Eintrag zu Natriumhydrogencarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Februar 2008 (JavaScript erforderlich).
- ↑ a b Datenblatt Natriumhydrogencarbonat bei Merck, abgerufen am 19. Januar 2011.
- ↑ Bikarbonatbatterie, S. E. Miederer, Fortschr Med.1994,Jun 10; 112(16):235–8, PubMed
- ↑ Sportlerernährung und Sportlernahrung: Eine aktuelle Bestandsaufnahme. Abgerufen am 26. Oktober 2011.
- ↑ Antidot-Monographie für Natriumhydrogencarbonat(PDF)
Weblinks
Wikimedia Foundation.




