- Kugelwolke
-
Das Kugelwolkenmodell (KWM) ist ein im Schulunterricht häufig verwendetes Atommodell, mit dem sich viele Phänomene (Atombindung, Molekülbau) erklären lassen. Es stellt eine Erweiterung des Bohrschen Atommodells dar und ist eine Vereinfachung gegenüber dem genaueren Orbitalmodell.
Aus dem Schalenmodell von Bohr übernommen sind die Elektronenschalen, die um den Atomkern angeordnet sind. In jeder Schale sind jeweils 2 Elektronen in einer Kugelwolke (kugeligen Elektronenwolke) zusammengefasst. Die Elektronenwolke ist als "Aufenthaltsraum" für die Elektronen zu verstehen, in dem diese sich bewegen. Aufgrund der zunehmenden Größe der Schalen passen dementsprechend immer mehr Elektronenwolken auf eine Schale.
- Erste Schale (K-Schale) = 2 Elektronen = 1 Elektronenwolke
- Zweite Schale (L-Schale) = 8 Elektronen = 4 Elektronenwolken
- Dritte Schale (M-Schale) = 18 Elektronen = 9 Elektronenwolken
- Vierte Schale (N-Schale) = 32 Elektronen = 16 Elektronenwolken
Die Anzahl Elektronen, die in der n-ten Schale Platz haben, berechnen sich nach der Formel 2×n². Allerdings nimmt jede äußere Schale, wie schon im Bohrschen Modell festgelegt, zunächst nicht mehr als 8 Elektronen auf.
Inhaltsverzeichnis
Regeln zum Auffüllen der Elektronenwolken
- In der ersten Schale gibt es nur eine Kugelwolke, die zentral um den Kern angeordnet ist.
- Ab der zweiten Schale werden immer erst 4 Elektronenwolken angelegt, erst in den Nebengruppen werden sie auf die Endzahl erweitert (allerdings spielt das bei der chemischen Bindung keine Rolle!)
- Jede der vier Elektronenwolken wird aufgrund der Abstoßung der Elektronen zuerst einfach besetzt. Erst ab dem 5. Elektron auf der Schale sind die Elektronen paarweise in den Elektronenwolken verteilt.
- Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie tetraedrisch angeordnet sind.
- Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.
Beispiele

Wasserstoffatom
Die erste Schale hat nur eine Kugelwolke, die zentrisch um den Kern angeordnet ist.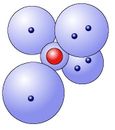
Sauerstoffatom
In der zweiten Schale gibt es vier Kugelwolken, die beim Sauerstoff zusammen 6 Elektronen aufnehmen müssen.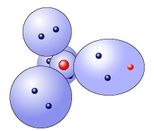
Chlorwasserstoffmolekül
Die Bindung kommt durch Überlappung der einfach besetzten Elektronenwolken vom Wasserstoff und Chlor zustandeVereinfachung Lewis-Schreibweise
In der Schreibweise nach Lewis werden Elektronenpaare durch Striche und einzelne Elektronen durch Punkte ersetzt.
Sauerstoffatom mit zwei freien Elektronenpaaren

Siehe auch
Wikimedia Foundation.



